Nombre: Luis Antonio Sarmiento Chancay
Curso: S1N
Materia: química
Tema: resumen de las clases del primer parcial
Catedrático: lcda. mariuxi adanaque
QUÍMICA RESUMEN DEL PRIMER PARCIAL
PRIMERA UNIDAD
INTRODUCCIÓN A LA QUÍMICA GENERAL
INTRODUCCIÓN A LA QUÍMICA GENERAL
la quimica ah servido al avance cientifico y tecnologico; es asi que en campos como la medicina , la industria, entre otros, su intervencion ha sido relevante. el analisis de ciertas elementos quimicos es indispensable a la hora de definir el desarrollo de una nueva medicina o de una nueva herramienta tecnologica; las propiedades fisicas y quimicas que estos presentan son utilizadas para definir la especialidad de su aplicacion.
por ello, es muy significativo el aporte que esta ciencia brinda al desarrollo de nuevas formas de vida simplificando los procesos ayudando a la supervivencia de los seres humanos, integrando nuevos pensamientosque evolucionan por el interes innato del hombre por la investigacion.
dentro de tu campo de estudio es indispensable que tengas un conocimiento sobre quimica, puesto que en base a ello podras interpretar fenomenos naturales e incluso brindar soluciones a problemas que te atañen a diario partiendo de teorias cientificas y experimentos realizados con anterioridad.
1.1 generalidades de la química.
la química
Es una ciencia natural que estudia la materia: ya sea su constitución sus propiedades químicas y físicas, los cambios químicos y físicos que esta experimenta y por ende su comportamiento y leyes que ah esta la rigen
objetivos de la química.
- interpretar claramente el concepto de quimica y su gran importancia en el campo de la industria.
- comprender todo lo relacionado a la materia ya sea su estructura, sus componentes, y sus propiedades.
- aprender a diferenciar las propiedades de la materia y su estructura
- explicar las relaciones que encontramos entre la materia y energia
- aprender a interpretar las reacciones que se generan entre los cuerpos y las leyes que las rigen.
- comprender los fenomenos que se producen y que de cierta forma modifican de un modo permanente las propiedades de la materia.
operaciones fundamentales de la quimica:
se ha descubierto mediante la quimica operaciones o procedimientos experimentales para un mejor estudio de la composicion y estructura de la materia que sera muy util para descomponer los materiales conocidos para hallar sus componentes mas sencillas.
analisis
suele ser la simplificacion, descomposicion o desintegracion de los materiales comunmente conocidos para investigar los componentes mas sencillos de una muestra quimica.
sintesis
esta operacion es totalmente contraria al analisis. las intesis consiste en formar una sustancia partiendo de los elementos que lo componen.
relación de la química con otras ciencias
BENEFICIOS DE LA QUÍMICA
La quimica va de la mano con otras ciencia nos brindara, muchos beneficios; dichos beneficis son:
- nos permite la conservacion de los alimentos.
- es muy importante para nuestra salud (medicamentos) y para poder tener una mejor calidad de vida.
- la quimica tambien tiene fines cosmetologicos o esteticos (labiales, esmaltes, etc.)
- la quimica se utiliza para la elaboracion de material de construccion tales como el cemento, las varillas de hierro entre otros
RIESGOS DE LA QUÍMICA
Es todo material nocivo o perjudicial, que durante la fabricacion, almacenamiento, transporte o uso, se puede generar o desprender humos, gases, vapores, polvos o fibras de naturaleza peligrosa, ya sea explosiva, inflamable, toxica, infecciosa, radiactiva, corrosiva o irritante en cantidad que tengan probabilidad de causar lesiones quimicas y daños a personas, instalaciones o medio ambiente.
NORMAS PARA REDUCIR LOS RIESGOS QUÍMICOS:
- Mantener la cantidad almacenada al mínimo operativo.
- considerar las características de peligrosidad de los productos y sus incompatibilidades
- agrupar los de características similares
- separar los incompatibles
- aislar o confinar los de características especiales
- comprobar etiquetados.
- llevar un registro actualizado de productos almacenados.
- emplear armarios de seguridad.
video sobre normas de seguridad dar clic en el enlace
LA QUIMICA Y EL MEDIO AMBIENTE
las cuestiones medioambientales como el cambio climático, la contaminación del agua y las energías renovables ocupan la portada de los periódicos y están cobrando mucha importancia en nuestra vida cotidiana. Mucha gente considera que las industrias químicas y la química en sí son muy perjudiciales para el medio ambiente. No obstante, son numerosos los avances y las investigaciones científicas en el campo de la química que están permitiendo desarrollar unos materiales y unas aplicaciones que protegen el medio ambiente y conservan la calidad y el estilo de vida que deseamos.
MÉTODO CIENTÍFICO
Se define como metodo cientifico a un conjunto de pasos ordenados que son seguidos y empleados por el investigador, con el objetivo de ampliar el conocimiento cientifico de algun fenomeno observado, y que este sea de aplicacion util para el hombre.
El metodo cientifico consta de plantear el problema, formular hipotesis las cuales explican el problema, el diseño de experimentos para comprobar la hipotesis dadas.
1.2 MATERIA Y ENERGÍA
MATERIA:
Materia es todo lo que posee masa y ocupa un lugar en el espacio.
los cambios que la materia sufre involucra ganancia o perdida de energia
ENERGIA:
Es la capacidad para hacer un trabajo.
CUERPO:
es la porcion limitada de materia con forma determinada.
clasificación de la materia
para conocer mas sobre la materia es necesario clasificarla y describirla. ya hemos utilizado uno de los principales metodos de clasificacion de la materia a travez de los estados de agregacion: solido, liquido, gaseoso.
otro metodo de clasificacion muy importante es considerar su composicion. en general toda porcion de materia puede ser clasificada como sustancia pura o como mezcla.
SUSTANCIAS PURAS:
Las sustancias puras son homogeneas (composicion y propiedades uniformes en toda su extencio), los elementos y compuestos quimicos sos sustancias puras.
elemento quimico:
es una sustancia pura que no puede descomponerse en sustancias mas simples utilizando metodos quimicos clasicos. el atomo es la pieza mas pequeña que mantiene las caracteristicas del elemento.
compuesto quimico:
es una sustancia pura constituida por dos atomos de dos o mas elementos quimicos que interactuan y se unen quimicamente en proporciones definidas.
MEZCLAS:
las mezclas estan constituidas por dos o mas sustancias puras que conservan su propia identidad quimica y sus caracteristicas. ejemplo el aire, un jarabe,la mantequilla, el acero, el bronce, entre otros.
mezclas homogeneas:
son uniformes en todas sus partes ejemplo, los enjuagues bucales, la gasolina, el vino, entre otros. al las mezclas homogeneas se las conoce tambien como soluciones.
mezcla heterogenea:
no poseen composicion quimica uniforme en todas sus partes, el prefijo hetero significa DIFERENTE. generalmente al mezclar dos o mas sustancias se forman fases o porciones fisicas distintas y distribuidas de forma irregular. cada fase o porcion presenta propiedades diferentes de los demas.
VIDEO SOBRE CLASIFICACION DE LA MATERIA DAR CLIC.
EJERCICIOS DE CLASIFICACION DE LA MATERIA:
CLASIFICA ENTRE SUSTANCIA PURA, MEZCLA HOMOGÉNEA Y MEZCLA HETEROGÉNEA
AIRE : mezcla homogenea
PERFUME: mezcla homogenea
OXÍGENO EN UN TANQUE DE OXÍGENO DE UN HOSPITAL: sustancia pura compuesta
YODO: sustancia pura simple.
AZÚCAR: sustancia pura compuesta.
TIERRA Y AGUA: mezcla homogenea.
CAFÉ CON LECHE: mezcla homogenea.
PAPEL Y ASERRÍN: mezcla homogenea.
CLORO: sustancia pura simple.
PIEDRAS Y ARENA: mezcla homogenea.
SISTEMA MATERIAL
Un sistema material es un elemento o conjuntos de elementos que se aísla imaginariamente para facilitar su estudio, por Ej.
Recipiente con sal disuelta en agua
Mezcla de agua y alcohol
Recipiente con hielo y agua
Los sistemas están formados por fases, si son homogéneos por una sola fase, si son heterogéneos pueden tener dos, tres, cuatro o múltiples fases.
PROPIEDADES DE LA MATERIA
Cada material o sustancia tiene un conjunto de propiedades, características que le dan su identidad única. Las propiedades de las sustancias se clasifican como físicas o químicas.
PROPIEDADES ORGANOLEPTICAS
Las propiedades organolépticas son todas aquellas descripciones de las características físicas que tiene la materia en general, según las pueden percibir los sentidos, por ejemplo su sabor, textura, olor, color. Su estudio es importante en las ramas de la ciencia en que es habitual evaluar inicialmente las características de la materia sin la ayuda de instrumentos científicos.
ESTAS PROPIEDADES SE LAS CLASIFICA EN
• COLOR
• OLOR
• SABOR
• IMPRESIÓN AL TACTO
• SONIDO
El sabor:
Es la impresión que causa un alimento u otra sustancia, y está determinado principalmente por sensaciones químicas detectadas por el gusto (lengua) así como por el olfato (olor). El 80 % de lo que se detecta como sabor es procedente de la sensación de olor.1 El nervio trigémino es el encargado de detectar las sustancias irritantes que entran por la boca o garganta, puede determinar en ocasiones el sabor.
El olor:
El olor es la sensación resultante de la recepción de un estímulo por el sistema sensorial olfativo. El término indica tanto la impresión que se produce en el olfato, como lo que es capaz de producirlo. Es una propiedad intrínseca de la materia. El olor es el objeto de percepción del sentido del olfato.
color
Se puede distinguir por: Transparencia, la luz atraviesa la sustancia y llega así a nuestros ojos. Reflexión, la luz incide lateralmente y recién entonces nos impresiona.
Ej. Cuando vemos a través de vidrio vemos por transparencia.
Cuando vemos la superficie de un mueble lo vemos por reflexión
el sonido:
el sonido, por analogía prosódica con ruido, chirrido, rugido, etcétera), en física, es cualquier fenómeno que involucre la propagación en forma de ondas elásticas (sean audibles o no), generalmente a través de un fluido (u otro medio elástico) que esté generando el movimiento vibratorio de un cuerpo.
VIDEO SOBRE LAS PROPIEDADES ORGANOLEPTICAS, DAR CLIC
PROPIEDADES INTENSIVAS Y EXTENSIVAS
Propiedades Intensivas:
- No dependen de la cantidad de la materia, color, dureza, densidad, punto de fusión, etc.
Ejemplos de propiedades intensivas son la temperatura, la presión, la velocidad, el volumen específico volumen ocupado por la unidad de masa, el punto de ebullición, el punto de fusión, la densidad, viscosidad, dureza, concentración, solubilidad, olor, color, sabor, etc., en general todas aquellas que caracterizan a una sustancia diferenciándola de otras.
Propiedades extensivas de la materia:
- Dependen de la cantidad de materia, volumen, peso , longitud, etc.
- las propiedades extensivas son aquellas que sí dependen de la cantidad de sustancia o del tamaño de un cuerpo, son magnitudes cuyo valor es proporcional al tamaño del sistema que describe. Estas magnitudes pueden ser expresadas como la suma de las magnitudes de un conjunto de subsistemas que formen el sistema original.
Muchas magnitudes extensivas, como el volumen, la cantidad de calor o el peso, pueden convertirse en intensivas dividiéndolas por la cantidad de sustancia, la masa o el volumen de la muestra; resultando en valores por unidad de sustancia, de masa, o de volumen respectivamente; como lo son el volumen molar, el calor específico o el peso específico.
PROPIEDADES FISICAS:
Son aquellas que nos permiten identificar a la sustancia sin que sus moleculas se modifiquen o se alteren, es decir su composicion permanece inalterada.
se clasifican en:
- ductilidad: facilidad de transformarse en hilos.
- maleabilidad: capacidad para convertirse en laminas.
- dureza: resistencia que opone un cuerpo a ser rayado
- tenacidad: resistencia que opone un cuerpo a romperse.
- fragilidad: propiedad opuesta a la tenacidad
- viscosidad: es la oposicion o resistencia a fluir.
PROPIEDADES FISICAS GENERALES:
- INERCIA: Es la propiedad por la que todos los cuerpos tienden a mantenerse en su estado de reposo
- IMPENETRABILIDAD: Es la imposibilidad de que dos cuerpos distintos ocupen el mismo espacio simultáneamente. Es la resistencia que pone un cuerpo a ser traspasado. Ej. En un recipiente de 20 lts solo se puede colocar 20 lts de líquido, si se quiere colocar más este no cabe.
- DISCONTINUIDAD: Se refiere a que la materia está formada por partículas, antes se pensaba que la materia era continua, es decir, que podía dividirse infinitamente y cada pedacito conservaba sus propiedades. Pero al estar formada por partículas tiene un límite para la división por lo que se dice que la materia es discontinua.
- ELASTICIDAD: Propiedad que tienen los cuerpos de cambiar su forma cuando se les aplica una fuerza adecuada y de recobrar la forma original cuando se suspende la acción de la fuerza.
- INDESTRUCTIBILIDAD: Propiedad que tienen los cuerpos de ser indestructibles – Ley de Lavoisier. Ej. El Tungsteno, El Oro
- INDESTRUCTIBILIDAD: Propiedad que tienen los cuerpos de ser indestructibles – Ley de Lavoisier. Ej. El Tungsteno, El Oro
video sobre propiedades fisicas, dar clichttps://www.youtube.com/watch?v=PIREkPWS7F4
PROPIEDADES QUÍMICAS:
Son aquellas que nos indican la tendencia de las sustancias para reaccionar y transformarse en otras como oxidarse, combustionar, inflamarse, estallar, enmohecerse.
Sufren alteración en su estructura interna o molecular cuando actúan con otras sustancias. Ejemplo: El sodio reacciona violentamente con el agua fría para formar Hidróxido de sodio mientras que el Calcio reacciona muy lentamente con el agua para formar Hidróxido de Calcio
video sobre propiedades, quimicas, dar clic.
EJERCICIO:
identifica y clasifica entre propiedad quimica o propiedad fisica.
- color --- propiedad quimica
- flamabilidad--- propiedad quimica
- dureza--- propiedad fisica
- olor-- propiedad fisica
- sabor-- propiedad fisica
- combustion de madera--- propiedad quimica
- agua bullendo se convierte en vapor--- propiedad quimica
- oxidacion de metal---- propiedad quimica
CAMBIOS FISICOS
- no varia la composicion quimica de la materia.
- lo que se tiene al principio se obtiene al final.
- no se forman nuevas sustancias.
CAMBIOS QUIMICOS:
- alteran la composicion quimica de la materia.
- originan otras sustancias.
video sobre los cambios quimicos y fisicos.
ESTADO DE LA MATERIA.
A travez de la teoria cinetica molecular podemos explicar los tres estado fisicosde la materia (estados de agregacion) de la materia: solido, liquido, gaseoso.e xisten sustancias como el agua que se pueden manifestar en tres estado en la naturalez otras , al contrario, al cambiar su estado de agregacion se descomponen en nuevas sustancias.
ESTADO SOLIDO:
en este estado las molecuals presentan una fuerza de cohesion o atraccion muy intensa por lo cual se encuentran muy unidas y el espacio intermolecular es muy reducido. esto hace imposible que las moleculas puedan desplazarse, existiendo unicamnte una vibracion entre ellas.
ESTADO LIQUIDO:
En este estado las moléculas presentan una fuerza de cohesion y de repulsion iguales comp para impedir que se separen pero no mantenerlas fijas, por este hecho las moleculas pueden deslizarse o resbalarse entre ellas ya que existe un mayor espacio intermolecular en comparacion con el estado solido es decir pueden fluir y adoptar la forma del recipiente que las contiene.
ESTADO GASEOSO:
En este estado las fuerzas de cohesion son casi nulas por lo que las moleculas estan en constante movimiento a grandes velocidades debido a esto un gas puede expandirse con gran rapidez, mezclarse, o llenar los espacios disponible en un recipiente. es comun que cuando pasamos por la carretera frente a una fabrica de chocolate podamos oler el rico aroma a cacao debido a estas caracteristicas de los gases.
EJERCICIO
Anota la letra inicial del estado de agregacin (S, L Y G), que corresponda a la caracteristica que se menciona:
- ( G) moleculas muy separadas
- (S) possen forma propia
- (L) toma la forma del recipiente que lo contiene
- (S) ocupan todo el volumen disponible
- (S) particulas muy unidas
- (G) estado en el cual las fuerzas de cohesion son muy bajas
- (L) estado de agregacion donde le cual las particulas resbalan unas sobre otras en desorden.
video sobre estados fisicos de la materia, dar clic https://www.youtube.com/watch?v=QH5KsBJYVUI
CAMBIOS DE ESTADO DE LA MATERIA.
cuando se adicion o se quita energia (calor) a la materia esta ultima experimenta transformaciones de un estado a otro caracterizados por el cambio de orden de las moleculas.
por ello cuando dejamos destapado un frasco con alcohol antiseptico, al transcurrir los dias notaremos que el alcohol se evapora, otro ejemplo seria cuando utilizamos un ambientador en pastilla(solido), que se sublima a temperatura ambiente. el siguiente gafico muestra los diferentes cambios de estado: fusion solidificacion vaporizacion, condensacion, sublimacion y deposicion.
FUSIÓN:
es el paso de un solido al estado liquido por medio del calor procedo endotermico.
el punto de fusion es la temperatura por la cual el solido se funde, por o que su valor es particular para cada sustancia.
SOLIDIFICACIÓN:
es el paso de liquido a solido por medio del enfriamiento proceso exotermico.
el punto de solidificacion o enfriamiento es la cual el liquido se solidifica y permanece constante durante el cambio.
VAPORIZACIÓN:
es el cambio de liquido a gaseoso, hay dos tipos de vaporizacion, la ebullicion y la evaporacion.
ebullicion cuando el cambio ocurre por aumento de temperatura en el interior del liquido, ( el liquido hierve )
evaporacion, se produce a cualquier temperatura siendo esta mas rapida cuanto mas elevada esta.
CONDENSACIÓN:
Es el paso de la forma liquida es el proceso inverso a la vaporizacion
el proceso de condensación suele tener ligar cuando un gas es enfriado hasta su punto de rocio, sin embargo este punto también puede ser alcanzado variando la presión.
SUBLIMACIÓN:
Es el cambio de estado de la materia solida al estado gaseoso sin pasar por el estado liquido
al proceso inverso se denomina sublimación inversa.
ENERGÍA
- la energía es una propiedad asociada a los objetos y sustancias y se manifiesta en las transformaciones que ocurren en la naturaleza.
- la energía que se manifiesta en los cambios físicos por ejemplo al elevar un objeto, transportarlo, deformarlo o calentarlo.
- la energía esta presente tambien en los cambios quimicos, como al quemar un trozo de madera o en la descomposición de agua mediante la corriente eléctrica.
PROPIEDADES FISICAS GENERALES:
- INERCIA: Es la propiedad por la que todos los cuerpos tienden a mantenerse en su estado de reposo
- IMPENETRABILIDAD: Es la imposibilidad de que dos cuerpos distintos ocupen el mismo espacio simultáneamente. Es la resistencia que pone un cuerpo a ser traspasado. Ej. En un recipiente de 20 lts solo se puede colocar 20 lts de líquido, si se quiere colocar más este no cabe.
- DISCONTINUIDAD: Se refiere a que la materia está formada por partículas, antes se pensaba que la materia era continua, es decir, que podía dividirse infinitamente y cada pedacito conservaba sus propiedades. Pero al estar formada por partículas tiene un límite para la división por lo que se dice que la materia es discontinua.
- ELASTICIDAD: Propiedad que tienen los cuerpos de cambiar su forma cuando se les aplica una fuerza adecuada y de recobrar la forma original cuando se suspende la acción de la fuerza.
- INDESTRUCTIBILIDAD: Propiedad que tienen los cuerpos de ser indestructibles – Ley de Lavoisier. Ej. El Tungsteno, El Oro
- INDESTRUCTIBILIDAD: Propiedad que tienen los cuerpos de ser indestructibles – Ley de Lavoisier. Ej. El Tungsteno, El Oro
video sobre propiedades fisicas, dar clichttps://www.youtube.com/watch?v=PIREkPWS7F4
PROPIEDADES QUÍMICAS:
Son aquellas que nos indican la tendencia de las sustancias para reaccionar y transformarse en otras como oxidarse, combustionar, inflamarse, estallar, enmohecerse.
Sufren alteración en su estructura interna o molecular cuando actúan con otras sustancias. Ejemplo: El sodio reacciona violentamente con el agua fría para formar Hidróxido de sodio mientras que el Calcio reacciona muy lentamente con el agua para formar Hidróxido de Calcio
video sobre propiedades, quimicas, dar clic.
EJERCICIO:
identifica y clasifica entre propiedad quimica o propiedad fisica.
- color --- propiedad quimica
- flamabilidad--- propiedad quimica
- dureza--- propiedad fisica
- olor-- propiedad fisica
- sabor-- propiedad fisica
- combustion de madera--- propiedad quimica
- agua bullendo se convierte en vapor--- propiedad quimica
- oxidacion de metal---- propiedad quimica
CAMBIOS FISICOS
- no varia la composicion quimica de la materia.
- lo que se tiene al principio se obtiene al final.
- no se forman nuevas sustancias.
CAMBIOS QUIMICOS:
- alteran la composicion quimica de la materia.
- originan otras sustancias.
video sobre los cambios quimicos y fisicos.
ESTADO DE LA MATERIA.
A travez de la teoria cinetica molecular podemos explicar los tres estado fisicosde la materia (estados de agregacion) de la materia: solido, liquido, gaseoso.e xisten sustancias como el agua que se pueden manifestar en tres estado en la naturalez otras , al contrario, al cambiar su estado de agregacion se descomponen en nuevas sustancias.
ESTADO SOLIDO:
en este estado las molecuals presentan una fuerza de cohesion o atraccion muy intensa por lo cual se encuentran muy unidas y el espacio intermolecular es muy reducido. esto hace imposible que las moleculas puedan desplazarse, existiendo unicamnte una vibracion entre ellas.
ESTADO LIQUIDO:
En este estado las moléculas presentan una fuerza de cohesion y de repulsion iguales comp para impedir que se separen pero no mantenerlas fijas, por este hecho las moleculas pueden deslizarse o resbalarse entre ellas ya que existe un mayor espacio intermolecular en comparacion con el estado solido es decir pueden fluir y adoptar la forma del recipiente que las contiene.
ESTADO GASEOSO:
En este estado las fuerzas de cohesion son casi nulas por lo que las moleculas estan en constante movimiento a grandes velocidades debido a esto un gas puede expandirse con gran rapidez, mezclarse, o llenar los espacios disponible en un recipiente. es comun que cuando pasamos por la carretera frente a una fabrica de chocolate podamos oler el rico aroma a cacao debido a estas caracteristicas de los gases.
EJERCICIO
Anota la letra inicial del estado de agregacin (S, L Y G), que corresponda a la caracteristica que se menciona:
- ( G) moleculas muy separadas
- (S) possen forma propia
- (L) toma la forma del recipiente que lo contiene
- (S) ocupan todo el volumen disponible
- (S) particulas muy unidas
- (G) estado en el cual las fuerzas de cohesion son muy bajas
- (L) estado de agregacion donde le cual las particulas resbalan unas sobre otras en desorden.
video sobre estados fisicos de la materia, dar clic https://www.youtube.com/watch?v=QH5KsBJYVUI
CAMBIOS DE ESTADO DE LA MATERIA.
cuando se adicion o se quita energia (calor) a la materia esta ultima experimenta transformaciones de un estado a otro caracterizados por el cambio de orden de las moleculas.
por ello cuando dejamos destapado un frasco con alcohol antiseptico, al transcurrir los dias notaremos que el alcohol se evapora, otro ejemplo seria cuando utilizamos un ambientador en pastilla(solido), que se sublima a temperatura ambiente. el siguiente gafico muestra los diferentes cambios de estado: fusion solidificacion vaporizacion, condensacion, sublimacion y deposicion.
FUSIÓN:
es el paso de un solido al estado liquido por medio del calor procedo endotermico.
el punto de fusion es la temperatura por la cual el solido se funde, por o que su valor es particular para cada sustancia.
SOLIDIFICACIÓN:
el punto de solidificacion o enfriamiento es la cual el liquido se solidifica y permanece constante durante el cambio.
VAPORIZACIÓN:
es el cambio de liquido a gaseoso, hay dos tipos de vaporizacion, la ebullicion y la evaporacion.
ebullicion cuando el cambio ocurre por aumento de temperatura en el interior del liquido, ( el liquido hierve )
evaporacion, se produce a cualquier temperatura siendo esta mas rapida cuanto mas elevada esta.
CONDENSACIÓN:
Es el paso de la forma liquida es el proceso inverso a la vaporizacion
el proceso de condensación suele tener ligar cuando un gas es enfriado hasta su punto de rocio, sin embargo este punto también puede ser alcanzado variando la presión.
SUBLIMACIÓN:
Es el cambio de estado de la materia solida al estado gaseoso sin pasar por el estado liquido
al proceso inverso se denomina sublimación inversa.
ENERGÍA
ENERGÍA
- la energía es una propiedad asociada a los objetos y sustancias y se manifiesta en las transformaciones que ocurren en la naturaleza.
- la energía que se manifiesta en los cambios físicos por ejemplo al elevar un objeto, transportarlo, deformarlo o calentarlo.
- la energía esta presente tambien en los cambios quimicos, como al quemar un trozo de madera o en la descomposición de agua mediante la corriente eléctrica.
´´la energia no se crea ni se destruye solo se transforma´´.
TIPOS DE ENERGIA:
ENERGIA QUIMICA:
es la que se produce en las relaciones quimicas, puede estar retenida en alimentos o elementos combustibles etc.
ENERGIA ELECTRICA:
es causada por el movimiento de las cargas electricas en el interior de los materiales conductores. es una de las formas de energia mas empleadas.
ENERGIA LUMINOSA:
es la que se transporta por la luz y siempre es producida por las ondas de luz, proviene de cualquier fuente de luz como el sol una bombilla el fuego etc.
ENERGIA SOLAR:
es la que llega a la tierra en forma de radiacion (luz, calor, rayos, ultravioletas, principalmente) procedente del sol.
ENERGIA MECANICA:
se refiere a la posicion y movimiento de un cuerpio y la suma de las energia de un cuerpo en movimiento
ENERGIA HIDRAULICA:
es aquella que se extrae del aprovechamiento de la energia cinetica y potencial de la corriente de los rios, saltos de agua y mareas.
ENERGIA NUCLEAR:
es la liberada del resultado de una reaccion nuclear, se pued eobtener mediante fusion nuclear, ( union de los nucleos atomicos) o por fusion nuclear ( division de nucleos atomicos)
ENERGIA ELECTROMAGNETICA:
se define como la cantidad de energia almanecenada en una parte del espacio y que se expresa segun la fuerza de un campo electricoy magnetico.
ENERGIA EOLICA:
se obtiene a travez del tiempo gracias a la energia cinetica generada por el efecto corrientes de aire, es utilizada para producir energia electrica o electricidad.
video sobre tipos de energia, dar clic: https://www.youtube.com/watch?v=aZlo_epRHEg
LEY DE LA CONSERVACIÓN DE LA MASA
Un serio problema de la teoria del flogisto involucra el cambio de masa durante las reacciones. por ejemplo si quemamos a un pedazo de leño, despues del cambio quimico quedara una maa menor a la original entonces nos preguntamos ¿QUE SUCEDIO CON LA AMSA FALTANTE?
respaldada por el trabajo del cientifico ANOINE LAVOISIER, sta ley sostiene que la materia (la masa) no puede crearse o destruirse durante una reaccion quimica sino solo transformarse o sufrir cambios de forma. es decir que la cantidas de materia al inicio y al final de una reaccion permanece constante.
´´En toda reaccion quimica la masa se conserva, esto es, la masa total de los reactivos es igual a la masa total de los productos´´
ejemplo:
Así, por ejemplo, cuando se hacen reaccionar 7 g de hierro con 4 g de azufre se obtienen 11 g de sulfuro de hierro:
Fe + S FeS
7g + 4g = 11g
masa = masa
Reactivos productos
EJERCICIOS
32g de azufre se calientan con 56g de hierro, formando como producto único el sulfuro ferroso. ¿Qué cantidad de producto se obtiene de esta reacción?
S + FE=
32G + 56G = 88G DE SULFURO FERROSO
Si se reaccion 5g de un compuesto A con 10g de un compuesto B, ¿que cantidad de compuesto C se obtiene como producto de la reaccion?
A + B
5g + 10g = 15g de compuesto c
LEY DE LA CONSERVACIÓN DE LA ENERGÍA.
A principio del siglo XIX, los cientificos se habian dado cuenta que la energia se presenta en la naturaleza de diferentes formas (cinetica, potencial, termica) a partir de estas aserveraciones el cientifico britanico JAMES PRESCOTT JOULES, con ayuda de sus exprimentos fue uno de los primeros en demostrar que en una forma de energia puede ser convertida en otras formas por lo cual en su honor a la unidad de energia en el sistema internacional de unidades se la denomino JOULE.
Gracias a los experimentos de JOULE, otros científicos descubrieron que la energía se conserva durante su conversión a otras formas estos científicos fueron los alemanes HERMANN VON HERLMHOLTZ y JULIUS ROBERT VON MAYER. e
llos formularon la ley de la conservación de la energía (primera ley de la termodinámica) la suma de las energías cinética y potencial, térmica en un sistema cerrado permanece constante.
UNIDADES DE CONVERSIÓN: SISTEMA INTERNACIONAL DE UNIDADES
DENSIDAD DE UN MATERIAL.
las diferentes particulas existen en la naturaleza estan conformadas por particulas (atomos, iones, moleculas) que segun las condiciones de presion y temperatura a las que se encuentran definiran el estado de la materia (solido, liquido, gaseoso) y una condicion muy caracteristica.
para caracterizar el estado tan singular de la sustancia se emplea la propiedad fisica
P= M/V
Por
lo tanto la masa y el volumen de una sustancia la podemos evaluar así:
masa:
m = ρ . V
Volumen: V = m / ρ
Unidades: Las
unidades en la que puede estar la densidad son:
ENERGIA POTENCIAL.
Es igual a la masa del cuerpo multiplicada por la gravedad y por la altura a la que se encuentra desde un centro de referencia.
la gravedad es una constante de 9,8m/s2
Ep = m . g . h
ENERGIA CINETICA:
la energia cinetica es igual a un medio del producto entre la masa y el cuadrado de la velocidad.
Ec = 1/2 . m . v2
ENERGIA MECANICA:
la energia mecanica es la suma entre la energia potencial y cinetica.
Em = Ep + Ec
UNIDADES DE ,EDIDA DE TEMPERATURA:
La temperatura es una magnitud fisica que se refleja la cantidad de calor ya sea de un cuerpo de un objeto o del ambiente dicha magnitud esta vinculada a la nocion de frio menor temperatura y caliente mayor temperatura.
ESCALAS DE TEMPERATURA
Escalas Relativas: Consideran como referencia el punto de ebullición y solidificación de una sustancia o mezcla.
Escala Celsius o Centígrado: Toma como compuesto de referencia el agua: punto de ebullición 100 ° C y punto de solidificación 0 °C. El nombre se debe al físico Andrés Celsius que la propuso en 1742
Escala Fahrenheit: Toma como referencia el punto de congelamiento de una solución amoniacal 0 °F. La temperatura de congelación del agua es de 32° F y la de ebullición es de 212 °F.
Escalas absolutas: Son las que consideran al cero absoluto como punto de referencia, en el cero absoluto se considera que no existe movimiento molecular
Escala Kelvin: El punto de congelamiento del agua es 273 K y el de ebullición 373 K. Llamada así en honor a su creador, el físico inglés William Kelvin. No lleva el símbolo de grados °
Escala Rankine: El punto de congelamiento del agua es 492 ° R
FÓRMULAS:
°C = 5(°F-32)/9
°F = 9 °C/5 + 32
K = °C + 273
R = °F + 459,67
1.3 EL ÁTOMO
En la filosofía de la antigua Grecia, la palabra ´´átomo´´ se empleaba para referirse a las partes de la materia mas pequeño que podía concebirse. la palabra átomo significa en griego ´´no divisible´´.
en el siglo V antes de cristo, el filosofo griego democrito postulo sin evidencia científica, que el universo estaba compuesto por partículas muy pequeñas e indivisibles, las cuales las llamo ÁTOMOS.
a esta postulacion se le llamo ATOMISMO, la cual hablaba de la existencia de átomos indestructibles indivisibles.
Con los avances científicos y la aparición de la ciencia experimental se ha demostrado que la estructura atómica integra a partículas mas pequeñas.
Los átomos se clasifican de acuerdo al número de protones y neutrones que contenga su núcleo. El número de protones o número atómico determina su elemento químico, y el número de neutrones determina su isotopo. Un átomo con el mismo número de protones que de electrones es eléctricamente neutro. Si por el contrario posee un exceso de protones o de electrones, su carga neta es positiva o negativa, y se denomina ion.

video sobre el atomo, dar clic en el link.
MODELOS ATÓMICOS
MODELO ATÓMICO DE DALTON.
Considerando la ley de la conservacion de la masa de lavoisier y la ley de las proporciones definidas, se realizaron una gran cantidad de experimentos en los laboratorios , los mismos que confirmaban estas leyes con el objetivo de explicar estas observaciones experimentals en el año de 1808, el ingles Jhon Dalton retomo los conceptos de Leucepio y Democrito para proponer una teoria atomica la cual recopilaba y explicaba con precision las unidades indivisibles con la que esta formada la materia .
La teoria atomica de daltonm se resume en los siguientes postulados:
1.- TODOS LOS ELEMENTOS ESTAN CONSTITUIDOS POR PARTICULAS EXTREMADAMENTE PEQUEÑAS LLAMADAS ATOMOS. NO SE CREA NI SE DESTRUYE ATOMOS DURANTE LAS REACCIONES QUIMICA,.
no pueden existir atomos fraccionables y ademas son indestructibles es decir conservan su identidad en los cambios fisicos y quimicos. este postulado ha sido comprobado experimentalmente con la ley de la conservacio de la masa de lavoisier.
2.- Todos los atomos de un mismo elemento son identicos, tiene igual tamaño masa y propiedads quimicas. los atomos de un elementos son diferentes a los atomos de todos los demas elementos.
3.- En la formación de moléculas de un mismo compuesto los elementos se combinan en proporciones fijas y pequeñas de números enteros.
4.- Los átomos de diferentes se combinan para forman mas de un compuesto. cada compuesto tiene una porción de átomos diferente pero definida y con una relación de números enteros.
este postulado quiere decir que se puede tener el caso en que la masa de un elemento se fija pero la masa del otro elemento sea variable, generando así otros compuestos.
5.- En las reacciones químicas los átomos de las sustancias iniciales reaccionan entre si, existiendo un cambio en la distribución atómica para forma nuevas y diferentes sustancias.
en este postulado dalton hace referencia a una descripción de lo que ocurre en las reacciones químicas y explica los resultados experimentales de Berzelius.
MODELO ATÓMICO DE THOMSON

Sir Joseph John Thomson (1856 -1940), fue un físico británico que descubrió la existencia del ELECTRÓN, partícula subatómica cargada negativamente. Según el modelo de Thomson, conocido como "modelo del pastel de pasas", el átomo consistía en una esfera uniforme de materia cargada positivamente en la que se hallaban incrustados los electrones de un modo parecido a como lo están las semillas en una sandía (patilla). Este sencillo modelo explicaba el hecho de que la materia fuese eléctricamente neutra, pues en los átomos de Thomson la carga positiva era neutralizada por la negativa.
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas: una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella.
¿SABIAS QUE ?
J.J. Thomson descubrió la primera partícula subatomica a la que llamo corpúsculo pero años mas tarde el físico irlandés George Johnstone le dio el nombre de electrón
¿SABIAS QUE?
J. J. Thomson se hizo acreedor del premio nobel de física en 1906, por sus investigaciones sobre la conductividad eléctrica de los gases. en ese mismo año formulo su teoría atómica
video sobre modelo atomico de thomson, dar clic en el link
MODELO ATOMICO DE RUTHERFORD
Sir Ernst Rutherford (1871 - 1937), famoso hombre de ciencia inglés que obtuvo el premio Nobel de Química en 1919, fue un físico neozelandés que identificó en 1898 dos tipos de las radiaciones emitidas por el Uranio, a las que llamó alfa y beta.
A Rutherford se le atribuye el descubrimiento del nucleo de los atomos y su modelo nuclear supero al modelo de thomson, fue en el año de 1911 cuando Rutherford para dar a conocer su nuevo modelo se ayudo en el experimento de la lamina de oro que se lo propuso como proyecto de investigacion a un estudiante de posgrado, Earnest Marsden en 1909 a peticion de su colega Hans Geiger el experimento consistia en investigar el efecto de las particulas alfa cuando colisionaban en una lamina delgada de oro como se muestra en la siguiente figura.

Rutehrford tomando como referencia el modelo de tohmson (la carga positiva y la dispersion homogenea de los electrones en el atomo), esperaba una desviacion menor de las particulas alfa ya que solo actuarian como pequeñas balas densas, positivamente no obstante de las observaciones de marsden rutherford expreso:
´´Puedo decirles confidencialmente que yo ne creia que tal cosa sucediera, pues sabíamos que la particula alfa era muy grande y con una gran cantidad de energia............. Recuerdo que dos o tres dia despues Geiger vino a mi con una gran emocion y dijo: Hemos podido detectar algunas particulas alfa que se regresan ........ fue la cosa mas increible que me ha ocurrido en toda la vida era casi como si dispararamos una bala de 15 pulgadas contra una hoja de papel y rebotara y nos golpeara´´.
video del modelo atomico de Rutherford, dar clic en el video
MODELO ATOMICO DE BOHR.
Después de los descubrimientos de Rutherford, los científicos pensaron en el átomo como un sistema solar microscópico, con los electrones girando en órbita alrededor del núcleo, Bohr al principio supuso que los electrones se movían en órbitas circulares, pero la física clásica decía que una partícula con carga eléctrica debía perder energía, lo que llevaría en un momento hacer al electrón caer hacia el núcleo, entonces Bohr dijo que las leyes conocidas de la física eran inadecuadas para describir algunos procesos de los átomos. El físico Danés Niels Bohr, premio Nobel de Física en 1922, introdujo en 1913 los tres postulados siguientes:
Primer Postulado: El producto del impulso o cantidad de movimiento (mv) del electrón por la longitud de la órbita que describe es un múltiplo del cuanto de energía (primer postulado).
Segundo Postulado: Mientras un electrón gira en una orbita fija no emite energía radiante.
Tercer Postulado: Un electrón puede saltar desde una orbita de energía a otra inferior de menor energía. En este salto el átomo emite una cantidad de energía radiante igual a la diferencia de energía de los estados inicial y final.
Aunque la teoría de Bohr fue de gran utilidad, tenía fallas, para empezar años después el electrón se identificó con un comportamiento de onda y en este modelo eso no se tomó en cuenta, además el modelo solo funcionaba para el hidrógeno, dejando fuera las relaciones electrón - electrón en átomos de muchos electrones.
VIDEO SOBRE MODELO ATOMICO DE DALTON, DAR CLIC EN EL LINK
video de la exposición dada
SI NO SE APRECIA EL VIDEO EH AQUI EL LINK DE YOUTUBE DONDE SE PUEDE VISUALIZAR EL VIDEO https://www.youtube.com/watch?v=vQGKjyR9f3U&feature=youtu.be
´´la energia no se crea ni se destruye solo se transforma´´.
TIPOS DE ENERGIA:
ENERGIA QUIMICA:
es la que se produce en las relaciones quimicas, puede estar retenida en alimentos o elementos combustibles etc.
ENERGIA ELECTRICA:
es causada por el movimiento de las cargas electricas en el interior de los materiales conductores. es una de las formas de energia mas empleadas.
ENERGIA LUMINOSA:
es la que se transporta por la luz y siempre es producida por las ondas de luz, proviene de cualquier fuente de luz como el sol una bombilla el fuego etc.
ENERGIA SOLAR:
es la que llega a la tierra en forma de radiacion (luz, calor, rayos, ultravioletas, principalmente) procedente del sol.
ENERGIA MECANICA:
se refiere a la posicion y movimiento de un cuerpio y la suma de las energia de un cuerpo en movimiento
ENERGIA HIDRAULICA:
es aquella que se extrae del aprovechamiento de la energia cinetica y potencial de la corriente de los rios, saltos de agua y mareas.
ENERGIA NUCLEAR:
es la liberada del resultado de una reaccion nuclear, se pued eobtener mediante fusion nuclear, ( union de los nucleos atomicos) o por fusion nuclear ( division de nucleos atomicos)
ENERGIA ELECTROMAGNETICA:
se define como la cantidad de energia almanecenada en una parte del espacio y que se expresa segun la fuerza de un campo electricoy magnetico.
ENERGIA EOLICA:
se obtiene a travez del tiempo gracias a la energia cinetica generada por el efecto corrientes de aire, es utilizada para producir energia electrica o electricidad.
video sobre tipos de energia, dar clic: https://www.youtube.com/watch?v=aZlo_epRHEg
LEY DE LA CONSERVACIÓN DE LA MASA
Un serio problema de la teoria del flogisto involucra el cambio de masa durante las reacciones. por ejemplo si quemamos a un pedazo de leño, despues del cambio quimico quedara una maa menor a la original entonces nos preguntamos ¿QUE SUCEDIO CON LA AMSA FALTANTE?
respaldada por el trabajo del cientifico ANOINE LAVOISIER, sta ley sostiene que la materia (la masa) no puede crearse o destruirse durante una reaccion quimica sino solo transformarse o sufrir cambios de forma. es decir que la cantidas de materia al inicio y al final de una reaccion permanece constante.
´´En toda reaccion quimica la masa se conserva, esto es, la masa total de los reactivos es igual a la masa total de los productos´´
ejemplo:
Así, por ejemplo, cuando se hacen reaccionar 7 g de hierro con 4 g de azufre se obtienen 11 g de sulfuro de hierro:
Fe + S FeS
7g + 4g = 11g
masa = masa
Reactivos productos
EJERCICIOS
32g de azufre se calientan con 56g de hierro, formando como producto único el sulfuro ferroso. ¿Qué cantidad de producto se obtiene de esta reacción?
S + FE=
32G + 56G = 88G DE SULFURO FERROSO
Si se reaccion 5g de un compuesto A con 10g de un compuesto B, ¿que cantidad de compuesto C se obtiene como producto de la reaccion?
A + B
5g + 10g = 15g de compuesto c
LEY DE LA CONSERVACIÓN DE LA ENERGÍA.
A principio del siglo XIX, los cientificos se habian dado cuenta que la energia se presenta en la naturaleza de diferentes formas (cinetica, potencial, termica) a partir de estas aserveraciones el cientifico britanico JAMES PRESCOTT JOULES, con ayuda de sus exprimentos fue uno de los primeros en demostrar que en una forma de energia puede ser convertida en otras formas por lo cual en su honor a la unidad de energia en el sistema internacional de unidades se la denomino JOULE.
Gracias a los experimentos de JOULE, otros científicos descubrieron que la energía se conserva durante su conversión a otras formas estos científicos fueron los alemanes HERMANN VON HERLMHOLTZ y JULIUS ROBERT VON MAYER. e
llos formularon la ley de la conservación de la energía (primera ley de la termodinámica) la suma de las energías cinética y potencial, térmica en un sistema cerrado permanece constante.
UNIDADES DE CONVERSIÓN: SISTEMA INTERNACIONAL DE UNIDADES
DENSIDAD DE UN MATERIAL.
las diferentes particulas existen en la naturaleza estan conformadas por particulas (atomos, iones, moleculas) que segun las condiciones de presion y temperatura a las que se encuentran definiran el estado de la materia (solido, liquido, gaseoso) y una condicion muy caracteristica.
para caracterizar el estado tan singular de la sustancia se emplea la propiedad fisica
P= M/V
Por
lo tanto la masa y el volumen de una sustancia la podemos evaluar así:
masa:
m = ρ . V
Volumen: V = m / ρ
Unidades: Las
unidades en la que puede estar la densidad son:
ENERGIA POTENCIAL.
Es igual a la masa del cuerpo multiplicada por la gravedad y por la altura a la que se encuentra desde un centro de referencia.
la gravedad es una constante de 9,8m/s2
Ep = m . g . h
ENERGIA CINETICA:
la energia cinetica es igual a un medio del producto entre la masa y el cuadrado de la velocidad.
Ec = 1/2 . m . v2
ENERGIA MECANICA:
la energia mecanica es la suma entre la energia potencial y cinetica.
Em = Ep + Ec
UNIDADES DE ,EDIDA DE TEMPERATURA:
La temperatura es una magnitud fisica que se refleja la cantidad de calor ya sea de un cuerpo de un objeto o del ambiente dicha magnitud esta vinculada a la nocion de frio menor temperatura y caliente mayor temperatura.
ESCALAS DE TEMPERATURA
Escalas Relativas: Consideran como referencia el punto de ebullición y solidificación de una sustancia o mezcla.
Escala Celsius o Centígrado: Toma como compuesto de referencia el agua: punto de ebullición 100 ° C y punto de solidificación 0 °C. El nombre se debe al físico Andrés Celsius que la propuso en 1742
Escala Fahrenheit: Toma como referencia el punto de congelamiento de una solución amoniacal 0 °F. La temperatura de congelación del agua es de 32° F y la de ebullición es de 212 °F.
Escalas absolutas: Son las que consideran al cero absoluto como punto de referencia, en el cero absoluto se considera que no existe movimiento molecular
Escala Kelvin: El punto de congelamiento del agua es 273 K y el de ebullición 373 K. Llamada así en honor a su creador, el físico inglés William Kelvin. No lleva el símbolo de grados °
Escala Rankine: El punto de congelamiento del agua es 492 ° R
FÓRMULAS:
°C = 5(°F-32)/9
°F = 9 °C/5 + 32
K = °C + 273
R = °F + 459,67
1.3 EL ÁTOMO
En la filosofía de la antigua Grecia, la palabra ´´átomo´´ se empleaba para referirse a las partes de la materia mas pequeño que podía concebirse. la palabra átomo significa en griego ´´no divisible´´.
en el siglo V antes de cristo, el filosofo griego democrito postulo sin evidencia científica, que el universo estaba compuesto por partículas muy pequeñas e indivisibles, las cuales las llamo ÁTOMOS.
a esta postulacion se le llamo ATOMISMO, la cual hablaba de la existencia de átomos indestructibles indivisibles.
Con los avances científicos y la aparición de la ciencia experimental se ha demostrado que la estructura atómica integra a partículas mas pequeñas.
Los átomos se clasifican de acuerdo al número de protones y neutrones que contenga su núcleo. El número de protones o número atómico determina su elemento químico, y el número de neutrones determina su isotopo. Un átomo con el mismo número de protones que de electrones es eléctricamente neutro. Si por el contrario posee un exceso de protones o de electrones, su carga neta es positiva o negativa, y se denomina ion.
video sobre el atomo, dar clic en el link.
MODELOS ATÓMICOS
MODELO ATÓMICO DE DALTON.
Considerando la ley de la conservacion de la masa de lavoisier y la ley de las proporciones definidas, se realizaron una gran cantidad de experimentos en los laboratorios , los mismos que confirmaban estas leyes con el objetivo de explicar estas observaciones experimentals en el año de 1808, el ingles Jhon Dalton retomo los conceptos de Leucepio y Democrito para proponer una teoria atomica la cual recopilaba y explicaba con precision las unidades indivisibles con la que esta formada la materia .
La teoria atomica de daltonm se resume en los siguientes postulados:
1.- TODOS LOS ELEMENTOS ESTAN CONSTITUIDOS POR PARTICULAS EXTREMADAMENTE PEQUEÑAS LLAMADAS ATOMOS. NO SE CREA NI SE DESTRUYE ATOMOS DURANTE LAS REACCIONES QUIMICA,.
no pueden existir atomos fraccionables y ademas son indestructibles es decir conservan su identidad en los cambios fisicos y quimicos. este postulado ha sido comprobado experimentalmente con la ley de la conservacio de la masa de lavoisier.
2.- Todos los atomos de un mismo elemento son identicos, tiene igual tamaño masa y propiedads quimicas. los atomos de un elementos son diferentes a los atomos de todos los demas elementos.
3.- En la formación de moléculas de un mismo compuesto los elementos se combinan en proporciones fijas y pequeñas de números enteros.
4.- Los átomos de diferentes se combinan para forman mas de un compuesto. cada compuesto tiene una porción de átomos diferente pero definida y con una relación de números enteros.
este postulado quiere decir que se puede tener el caso en que la masa de un elemento se fija pero la masa del otro elemento sea variable, generando así otros compuestos.
5.- En las reacciones químicas los átomos de las sustancias iniciales reaccionan entre si, existiendo un cambio en la distribución atómica para forma nuevas y diferentes sustancias.
en este postulado dalton hace referencia a una descripción de lo que ocurre en las reacciones químicas y explica los resultados experimentales de Berzelius.
MODELO ATÓMICO DE THOMSON
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas: una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella.
¿SABIAS QUE ?
J.J. Thomson descubrió la primera partícula subatomica a la que llamo corpúsculo pero años mas tarde el físico irlandés George Johnstone le dio el nombre de electrón
¿SABIAS QUE?
J. J. Thomson se hizo acreedor del premio nobel de física en 1906, por sus investigaciones sobre la conductividad eléctrica de los gases. en ese mismo año formulo su teoría atómica
video sobre modelo atomico de thomson, dar clic en el link
MODELO ATOMICO DE RUTHERFORD
Sir Ernst Rutherford (1871 - 1937), famoso hombre de ciencia inglés que obtuvo el premio Nobel de Química en 1919, fue un físico neozelandés que identificó en 1898 dos tipos de las radiaciones emitidas por el Uranio, a las que llamó alfa y beta.
A Rutherford se le atribuye el descubrimiento del nucleo de los atomos y su modelo nuclear supero al modelo de thomson, fue en el año de 1911 cuando Rutherford para dar a conocer su nuevo modelo se ayudo en el experimento de la lamina de oro que se lo propuso como proyecto de investigacion a un estudiante de posgrado, Earnest Marsden en 1909 a peticion de su colega Hans Geiger el experimento consistia en investigar el efecto de las particulas alfa cuando colisionaban en una lamina delgada de oro como se muestra en la siguiente figura.
Rutehrford tomando como referencia el modelo de tohmson (la carga positiva y la dispersion homogenea de los electrones en el atomo), esperaba una desviacion menor de las particulas alfa ya que solo actuarian como pequeñas balas densas, positivamente no obstante de las observaciones de marsden rutherford expreso:
´´Puedo decirles confidencialmente que yo ne creia que tal cosa sucediera, pues sabíamos que la particula alfa era muy grande y con una gran cantidad de energia............. Recuerdo que dos o tres dia despues Geiger vino a mi con una gran emocion y dijo: Hemos podido detectar algunas particulas alfa que se regresan ........ fue la cosa mas increible que me ha ocurrido en toda la vida era casi como si dispararamos una bala de 15 pulgadas contra una hoja de papel y rebotara y nos golpeara´´.
video del modelo atomico de Rutherford, dar clic en el video
MODELO ATOMICO DE BOHR.
Después de los descubrimientos de Rutherford, los científicos pensaron en el átomo como un sistema solar microscópico, con los electrones girando en órbita alrededor del núcleo, Bohr al principio supuso que los electrones se movían en órbitas circulares, pero la física clásica decía que una partícula con carga eléctrica debía perder energía, lo que llevaría en un momento hacer al electrón caer hacia el núcleo, entonces Bohr dijo que las leyes conocidas de la física eran inadecuadas para describir algunos procesos de los átomos. El físico Danés Niels Bohr, premio Nobel de Física en 1922, introdujo en 1913 los tres postulados siguientes:
Primer Postulado: El producto del impulso o cantidad de movimiento (mv) del electrón por la longitud de la órbita que describe es un múltiplo del cuanto de energía (primer postulado).
Segundo Postulado: Mientras un electrón gira en una orbita fija no emite energía radiante.
Tercer Postulado: Un electrón puede saltar desde una orbita de energía a otra inferior de menor energía. En este salto el átomo emite una cantidad de energía radiante igual a la diferencia de energía de los estados inicial y final.
Aunque la teoría de Bohr fue de gran utilidad, tenía fallas, para empezar años después el electrón se identificó con un comportamiento de onda y en este modelo eso no se tomó en cuenta, además el modelo solo funcionaba para el hidrógeno, dejando fuera las relaciones electrón - electrón en átomos de muchos electrones.
VIDEO SOBRE MODELO ATOMICO DE DALTON, DAR CLIC EN EL LINK
video de la exposición dada
SI NO SE APRECIA EL VIDEO EH AQUI EL LINK DE YOUTUBE DONDE SE PUEDE VISUALIZAR EL VIDEO https://www.youtube.com/watch?v=vQGKjyR9f3U&feature=youtu.be
MODELO CUÁNTICO.

El físico E. Schrödinger estableció el modelo mecano-cuántico del átomo, ya que el modelo de Bohr suponía que los electrones se encontraban en órbitas concretas a distancias definidas del núcleo; mientras que, el nuevo modelo establece que los electrones se encuentran alrededor del núcleo ocupando posiciones más o menos probables, pero su posición no se puede predecir con exactitud.
Con estas dos partículas, se intentó construir todos los átomos conocidos, pero no pudo ser así porque faltaban unas de las partículas elementales del núcleo que fue descubierto por J. Chadwick en 1932 y que se llamó neutrón. Esta partícula era de carga nula y su masa es ligerísimamente superior a la del protón (1,6748210-27kg.). Sin negar el considerable avance que supuso la teoría atómica de Bohr, ésta solo podía aplicarse a átomos muy sencillos, y aunque dedujo el valor de algunas constantes, que prácticamente coincidían con los valores experimentales sencillos, el modelo no fue capaz de explicar los numerosos saltos electrónicos, responsables de las líneas que aparecen en los espectros de los átomos que poseen más de un electrón.
Al modelo de Bohr se le fueron introduciendo mejoras, pero la idea de un átomo compuesto por orbitas alrededor de un núcleo central puede considerarse demasiado sencilla, no fue posible interpretar satisfactoriamente el espectro de otros átomos con más de un electrón (átomos poli electrónicos) ni mucho menos la capacidad de los átomos para formar enlaces químicos.
video sobre el experimento que realizo Schrödinger llamado el gato de Schrödinger, dar clic en el link
CONCLUSION: el atomo es la minima unidad de materia que puede existir representando las caracteristicas de un elemento, se representa por medio de simbolos: es la letra o letras que e emplean para reprsentarlos.
ejemplo:
Al (aluminio), Na (sodio), P (fosforo), C (carbono), He (helio), etc.
una molecual es un conjunto de atomos iguales o diferentes que se encuentran unidos mediante enlaces quimicos, el caso que los atomos sean identicos se da por ejemplo en el oxigeno (O2) que cuentan con dos atomos de este elemento, o pueden ser diferentes como ocurre con la molecula del agua la cual tiene dos atomos de hidrogeno y uno solo de oxigeno (H20)
LOS PROTONES CARGA ( + ) .
fueron descubierto por Ernest Rutherford a principios del siglo XX.
se encuentran en el nucleo. tiene carga electrica positiva.
LOS NEUTRONES ( 0 ) .
constituyen los nucleos de los atomos junto a los protones, fueron descubiertos en 1930 por dos fisicos alemanes Walter Bothe y Herbert Becker.
no tienen carga electrica ya que son neutros igual cantidad de protones y electrones por lo que tiene su carga 0.
LOS ELECTRONES ( - ).
se estan moviendo constantemente alrededor del nucleo siguiendo unas orbitas.
fueron descubiertos por Joseph Thomson en el año de 1897 es una particula subatomica tiene carga electrica negativa.
El físico E. Schrödinger estableció el modelo mecano-cuántico del átomo, ya que el modelo de Bohr suponía que los electrones se encontraban en órbitas concretas a distancias definidas del núcleo; mientras que, el nuevo modelo establece que los electrones se encuentran alrededor del núcleo ocupando posiciones más o menos probables, pero su posición no se puede predecir con exactitud.
Con estas dos partículas, se intentó construir todos los átomos conocidos, pero no pudo ser así porque faltaban unas de las partículas elementales del núcleo que fue descubierto por J. Chadwick en 1932 y que se llamó neutrón. Esta partícula era de carga nula y su masa es ligerísimamente superior a la del protón (1,6748210-27kg.). Sin negar el considerable avance que supuso la teoría atómica de Bohr, ésta solo podía aplicarse a átomos muy sencillos, y aunque dedujo el valor de algunas constantes, que prácticamente coincidían con los valores experimentales sencillos, el modelo no fue capaz de explicar los numerosos saltos electrónicos, responsables de las líneas que aparecen en los espectros de los átomos que poseen más de un electrón.
Al modelo de Bohr se le fueron introduciendo mejoras, pero la idea de un átomo compuesto por orbitas alrededor de un núcleo central puede considerarse demasiado sencilla, no fue posible interpretar satisfactoriamente el espectro de otros átomos con más de un electrón (átomos poli electrónicos) ni mucho menos la capacidad de los átomos para formar enlaces químicos.
video sobre el experimento que realizo Schrödinger llamado el gato de Schrödinger, dar clic en el link
CONCLUSION: el atomo es la minima unidad de materia que puede existir representando las caracteristicas de un elemento, se representa por medio de simbolos: es la letra o letras que e emplean para reprsentarlos.
ejemplo:
Al (aluminio), Na (sodio), P (fosforo), C (carbono), He (helio), etc.
una molecual es un conjunto de atomos iguales o diferentes que se encuentran unidos mediante enlaces quimicos, el caso que los atomos sean identicos se da por ejemplo en el oxigeno (O2) que cuentan con dos atomos de este elemento, o pueden ser diferentes como ocurre con la molecula del agua la cual tiene dos atomos de hidrogeno y uno solo de oxigeno (H20)
LOS PROTONES CARGA ( + ) .
fueron descubierto por Ernest Rutherford a principios del siglo XX.
se encuentran en el nucleo. tiene carga electrica positiva.
LOS NEUTRONES ( 0 ) .
constituyen los nucleos de los atomos junto a los protones, fueron descubiertos en 1930 por dos fisicos alemanes Walter Bothe y Herbert Becker.
no tienen carga electrica ya que son neutros igual cantidad de protones y electrones por lo que tiene su carga 0.
LOS ELECTRONES ( - ).
se estan moviendo constantemente alrededor del nucleo siguiendo unas orbitas.
fueron descubiertos por Joseph Thomson en el año de 1897 es una particula subatomica tiene carga electrica negativa.
ION: CATION Y ANIÓN
Se define al ion como un átomo o una molécula cargados eléctricamente, debido a que ha ganado o perdido electrones de su dotación normal, lo que se conoce como ionización.
Los iones cargados negativamente, producidos por la ganancia de electrones, se conocen como aniones y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes.
Un catión es un ion (sea átomo o molécula) con carga eléctrica positiva, esto es, con defecto de electrones. Los cationes se describen con un estado de oxidación positivo.
Un anión es un ion (sea átomo o molécula) con carga eléctrica negativa, esto es, con exceso de electrones. Los aniones se describen con un estado de oxidación negativo.
video sobre ion: cation y anion, dar clic en el link
Se define al ion como un átomo o una molécula cargados eléctricamente, debido a que ha ganado o perdido electrones de su dotación normal, lo que se conoce como ionización.
Los iones cargados negativamente, producidos por la ganancia de electrones, se conocen como aniones y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes.
Un catión es un ion (sea átomo o molécula) con carga eléctrica positiva, esto es, con defecto de electrones. Los cationes se describen con un estado de oxidación positivo.
Un anión es un ion (sea átomo o molécula) con carga eléctrica negativa, esto es, con exceso de electrones. Los aniones se describen con un estado de oxidación negativo.
video sobre ion: cation y anion, dar clic en el link
NÚMERO ATÓMICO Y MASA ATÓMICA DE LOS ELEMENTOS
la masa atomica o numero basico:
la masa atomica es la cantidad de materia que tiene un atomo y generalmente se obtiene al sumar z + n = A
z= el numero de protones
n= el numero de neutrones
a= masa atomica
EL NUMERO ATOMICO:
el numero atomico es el numero entero positivo que equivale al numero total de protones en un ncleo del atomo se suele representar con la letra Z, es caracteristico de cada elemento quimico y representa una propiedad fundamental del atomo, este hecho permitio clasificar a los elementos en la tabla periodica en orden creciente de numero atomico.
la masa atomica o numero basico:
la masa atomica es la cantidad de materia que tiene un atomo y generalmente se obtiene al sumar z + n = A
z= el numero de protones
n= el numero de neutrones
a= masa atomica
EL NUMERO ATOMICO:
el numero atomico es el numero entero positivo que equivale al numero total de protones en un ncleo del atomo se suele representar con la letra Z, es caracteristico de cada elemento quimico y representa una propiedad fundamental del atomo, este hecho permitio clasificar a los elementos en la tabla periodica en orden creciente de numero atomico.
Determinar la cantidad de protones y electrones
-
Busca en la tabla el elemento cuyo número de protones, neutrones y electrones estás tratando de averiguar.
-
Localiza el número atómico del elemento en la tabla periódica. Lo encontrarás mirando en la esquina superior izquierda de la casilla donde está el elemento. El número atómico te informa del número de protones que tiene un determinado elemento.
-
Calcula el número de electrones usando una vez más el número atómico. Un átomo contiene el mismo número de protones que de electrones. Por lo tanto, el número atómico de un elemento te indicará también cuántos electrones tiene.
Busca en la tabla el elemento cuyo número de protones, neutrones y electrones estás tratando de averiguar.
Localiza el número atómico del elemento en la tabla periódica. Lo encontrarás mirando en la esquina superior izquierda de la casilla donde está el elemento. El número atómico te informa del número de protones que tiene un determinado elemento.
Calcula el número de electrones usando una vez más el número atómico. Un átomo contiene el mismo número de protones que de electrones. Por lo tanto, el número atómico de un elemento te indicará también cuántos electrones tiene.
•Determinar la cantidad de neutrones
•Localiza el número
atómico del elemento cuya cantidad de neutrones deseas determinar.
•Redondea la cifra que
está en la parte de arriba de la casilla del elemento (peso atómico) al número
entero más próximo. Por ejemplo, un peso atómico de 36,43 se debe redondear a
36, mientras que uno de 75,78 se redondearía a 76.
•Anota el resultado del
redondeo
•Recuerda el número de
protones o electrones que calculaste con anterioridad. (Recuerda: siempre va a
ser el mismo número).
•Resta el número de
protones (o de electrones) al número obtenido en el paso 3, el del redondeo del
peso atómico. Esto te dará la cantidad correcta de neutrones del elemento
objeto de tu estudio. Por ejemplo, si el número de protones era de 34 y el peso
atómico fue redondeado a 76, tendrás 76 - 34 = 42, que será el número de
neutrones del elemento
MOLÉCULA:
•Localiza el número
atómico del elemento cuya cantidad de neutrones deseas determinar.
•Redondea la cifra que
está en la parte de arriba de la casilla del elemento (peso atómico) al número
entero más próximo. Por ejemplo, un peso atómico de 36,43 se debe redondear a
36, mientras que uno de 75,78 se redondearía a 76.
•Anota el resultado del
redondeo
•Recuerda el número de
protones o electrones que calculaste con anterioridad. (Recuerda: siempre va a
ser el mismo número).
•Resta el número de
protones (o de electrones) al número obtenido en el paso 3, el del redondeo del
peso atómico. Esto te dará la cantidad correcta de neutrones del elemento
objeto de tu estudio. Por ejemplo, si el número de protones era de 34 y el peso
atómico fue redondeado a 76, tendrás 76 - 34 = 42, que será el número de
neutrones del elemento
MOLÉCULA:
Es un conjunto de átomos unidos unos con otros por enlaces fuertes. Es la expresión
mínima de un compuesto o sustancia química, es decir, es una sustancia química
constituida por la unión de varios átomos que mantienen las propiedades químicas
específicas de la sustancia que forman.
Una macromolécula puede estar constituida por miles o hasta millones de átomos,
típicamente enlazados en largas cadenas.
Cada molécula tiene un tamaño definido y puede contener los átomos del mismo elemento
los átomos de diversos elementos.
Una sustancia que está compuesta por moléculas que tienen dos o más elementos
químicos, se llama compuesto químico.
Es un conjunto de átomos unidos unos con otros por enlaces fuertes. Es la expresión
mínima de un compuesto o sustancia química, es decir, es una sustancia química
constituida por la unión de varios átomos que mantienen las propiedades químicas
específicas de la sustancia que forman.
Una macromolécula puede estar constituida por miles o hasta millones de átomos,
típicamente enlazados en largas cadenas.
Cada molécula tiene un tamaño definido y puede contener los átomos del mismo elemento
los átomos de diversos elementos.
Una sustancia que está compuesta por moléculas que tienen dos o más elementos
químicos, se llama compuesto químico.
CONFIGURACIÓN ELECTRÓNICA.

La configuración electrónica de un átomo es una designación de la distribución de los
electrones entre los diferentes orbitales, en las capas principales y las subcapas. La
notación de la configuración electrónica utiliza los símbolos de subcapa (s, p, d y f) y cada
uno con un superíndice que indica el número de electrones en ese subnivel.
Por ejemplo para el Li el cual tiene 3 electrones sería, 1s2 2s1; el número que se encuentra
al lado de la subcapa es n, la letra representa el subnivel y el superíndice el número de
electrones en ese subnivel.
TIPOS DE CONFIGURACIÓN ELECTRÓNICA
Para graficar la configuración electrónica existen cuatro modalidades, con mayor o menor
complejidad de comprensión, que son:
Configuración estándar: Se representa la configuración electrónica que se obtiene usando
el cuadro de las diagonales. Es importante recordar que los orbitales se van llenando en el
orden en que aparecen, siguiendo esas diagonales, empezando siempre por el 1s.
Aplicando el mencionado cuadro de las diagonales la configuración electrónica estándar,
para cualquier átomo, es la siguiente:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
6p6 7s2 5f14 6d10 7p6
Configuración condensada: Los niveles que aparecen llenos en la configuración estándar
se pueden representar con un gas noble (elemento del grupo VIII), donde el número
atómico del gas coincida con el número de electrones que llenaron el último nivel. Los
gases nobles son He, Ne, Ar, Kr, Xe y Rn.
empleando flechas para simbolizar el spin de cada uno. El llenado se realiza respetando el
principio de exclusión de Pauli y la Regla de máxima multiplicidad de Hund.
Configuración semidesarrollada: Esta representación es una combinación entre la
configuración condensada y la configuración desarrollada. En ella sólo se representan
los electrones del último nivel de energía.
EJEMPLO DE CONFIGURACION ELECTRONICA
Configuración
electrónica del Ra: Z = 88 quiere decir que
tiene 88 e-
La
configuración electrónica es:
1 s2 2 s2 p6 3 s2 p6 d10 4s2 p6 d10 f14 5s2 p6 d10 6 s2 p6 7 s2
NÚMEROS CUÁNTICOS
1) NÚMERO CUÁNTICO PRINCIPAL (n)
Representa los niveles energéticos.
Se designa con números enteros positivos desde
n=1 hasta n=7 para los elementos
conocidos.
2) NÚMERO CUÁNTICO SECUNDARIO O
AZIMUTAL ( l )
Determina el subnivel y se
relaciona con la forma del orbital.
Cada
nivel
energético ( n ) tiene "n" subniveles.
Se
relaciona
con el giro del electrón sobre su propio eje. Al estar juntos en un mismo
orbital, un electrón gira hacia la derecha y otro hacia la izquierda. Se le
asignan
números fraccionarios: -1/2 y +1/2

3) NÚMERO CUÁNTICO MAGNÉTICO (m)
Representa los
orbitales presentes en un subnivel.

4) NÚMERO CUÁNTICO POR SPIN
(s)
Se relaciona con el giro del electrón sobre su propio eje. Al estar juntos en un mismo
orbital, un electrón gira hacia la derecha y otro hacia la izquierda. Se le asignan
números fraccionarios: -1/2 y +1/2
video sobre numeros cuanticos y configuracion electronica, dar clic en el link.https://www.youtube.com/watch?v=eDYGmDpNHaU
1.4 TABLA PERIÓDICA DE LOS ELEMENTOS

Tabla Periódica de Elementos Químicos.
La Tabla Periódica de Elementos Químicos clasifica, organiza y distribuye los distintos
elementos químicos, conforme a sus propiedades y características. La misma se le
atribuye al químico ruso Dimitri Ivanovich Mendeléiev, quien ordenó los elementos
basándose en la variación manual de las propiedades químicas, si bien Jullius Lothar
Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las p
ropiedades físicas de los átomos. La forma actual es una versión modificada de la de
Mendeléiev, fue diseñada por Alfred Werner.
Descripción: Los elementos se hallan distribuidos:
En 7 filas denominadas (periodos).
En 18 columnas o familias, las cuales se ordenan en grupos; 8 grupos A y 8 grupos B.
PERIODOS: Son las filas horizontales, nos indican el último nivel de energía del
elemento. Existen 7 periodos o niveles.
Periodo 1, 2 y 3, formados por 2, 8 y 8 elementos respectivamente, son denominados
Periodos cortos.
Periodos 4, 5 y 6 son los Periodos largos, el 7º periodo se halla incompleto.
clasificación de lavoisier:
el propio lavoisier dio la primera clasificación de elementos agrupando los mismo:
metales, no metales y metaloides o metales de transicion.
LOS METALES
sus propiedades fisicas son:
la mayoria son solidos
conductividad
brillo
dureza
maleabilidad y ductibilidad
el Hg es liquido
el Fe, Ni y Co presentan magnetismo.
PROPIEDADES QUIMICAS:
reactividad, facilidad y velocidad con la que un elemento se combina con otro para formar
un compuesto.
CARACTERISTICAS:
sus atomos estan ordenados de forma compacta formando cristales
tienden a perder el ultimo orbital.
METALES EN LA TABLA PERIODICA
los metales en grupo tiene propiedades similares, la reactividad de los metales tienden a
disminir al movernos de izquierda a derecha en la tabla periodica.
metales alcalinos GRUPO 1
son del Li, Fr, reaccionan con otros elementos perdiendo 1 e-
son los mas reactivos entre los metales
presentan baja dureza
los mas importantes son el Na y el K.
Metales alcalinotérreos: Grupo II
Ligeramente duros
Buenos conductores de electricidad
Reaccionan perdiendo dos electrones
Son menos reactivos que los metales alcalinos.
Los más importantes son el Ca y el Mg
Metales de transición
•Elementos del grupo 3
al 12
•Son duros y brillosos
•Son buenos conductores
de la electricidad
•Los más comunes son:
el Fe, Cu, Ni, Ag y Au
Metales del Grupo 13 al 15
Son los de menor reactividad de entre los metales.
Los de mayor utilidad son el Al, por ser de peso ligero, que se utiliza en piezas de aeroplanos;
el Sn, que se utiliza en fabricación de pinturas y tintas; y, el Pb, que se utiliza en las baterías
de automóviles.
Lantánidos
Son llamados elementos de transición interna
Son suaves, maleables
Presentan brillo y una alta conductividad
Se mezclan con elementos comunes para formar aleaciones
Se encuentran en abundancia en la corteza terrestre, en minerales como la monacita.
Actínidos
Son llamados elementos de transición interna
Son en total 15 y tienen periodos cortos de vida
Son isótopos radioactivos
Solo el Ac, Th, Pa y U se encuentran de manera natural.
El uranio se utiliza para producir energía en plantas nucleares
Propiedades Físicas
El C, I y S, son sólidos a temperatura ambiente.
El Br es el único no metal que es líquido a temperatura ambiente
Tienen puntos de fusión muy bajos y baja densidad
Características
Los átomos de los no metales, generalmente gana o comparten electrones
Son malos conductores del calor y la electricidad
CLASIFICACION DE LOS NO METALES SEGUN SUS FAMILIAS
HALÓGENOS
Son formadores de sales
Son muy reactivos
El cloro se utiliza para eliminar bacterias en el agua y vegetales
ANFÍGENOS
También llamado familia del oxígeno y es el grupo 16 (formado por los siguientes elementos:
(O), (S), (Se), (Te) y (Po).
El nombre de anfígeno en español deriva de la propiedad de algunos de sus elementos de
formar compuestos con carácter ácido o básico.
El oxígeno y el azufre se utilizan abiertamente en la industria
El telurio y el selenio en la fabricación de semiconductores
NITROGENOIDES
Esta familia está compuesta por los elementos químicos del grupo 15: N, P, As, Sb y Bi.
A altas temperaturas son muy reactivos
CARBONOIDES
La mayoría de los elementos de este grupo son muy conocidos y difundidos, especialmente el
carbono, elemento fundamental de la química orgánica.
El silicio es uno de los elementos más abundantes en la corteza terrestre (28%), y de gran
importancia en la sociedad a partir del siglo XX ya que es el elemento principal de los circuitos
integrados.
METALOIDES
CLASIFICACION
Propiedades Físicas
Son buenos conductores de la electricidad
El Si, Ge y As son utilizados para fabricar semiconductores
Propiedades Químicas
Reactividad, es variada, algunos son más reactivos que otros
Se los usa en las industrias acerera, agrícola, minería y en la producción de gas acetileno
Características
Son 7 elementos cuyas características son intermedias entre los metales y no metales
Sólidos a temperatura ambiente
VIDEO SOBRE LA CLASIFICACIÓN DE LA TABLA PERIÓDICA,DAR CLIC EN EL LINK
https://www.youtube.com/watch?v=ubtk60kUZjU
ENLACES Y TIPOS DE ENLACES
Los ENLACES son las uniones entre átomos para formar moléculas. Siempre que
existe una molécula es porque ésta es más estable que los átomos que la forman por
separado. A la diferencia de energía entre estos dos estados se le denomina energía
de enlace.
Generalmente, los átomos se combinan en proporciones fijas para dar moléculas. Por
ejemplo, dos átomos de hidrógeno se combinan con uno de oxígeno para dar una
molécula de agua. Esta proporción fija se conoce como estequiometria.
TIPOS DE ENLACES
ENLACE COVALENTE
ENLACE METÁLICO
ENLACE IONICO
ENLACE COVALENTE
Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para
alcanzar el octeto estable, compartiendo electrones del último nivel2 (excepto el
Hidrógeno que alcanza la estabilidad cuando tiene 2 electrones). La diferencia de
electronegatividad entre los átomos no es lo suficientemente grande como para que se
produzca una unión de tipo iónica. Para que un enlace covalente se genere es
necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7.
De esta forma,los dos átomos comparten uno o más pares electrónicos en un nuevo
tipo de orbital, denominado orbital molecular. Los enlaces covalentes se producen
entre átomos de un mismo elemento no metal y entre distintos elementos no metales.
Cuando átomos de distintos no metales se unen en forma covalente, uno de ellos
resultará más electronegativo que el otro, por lo que tenderá a atraer la nube
electrónica del enlace hacia su núcleo, generando un dipolo eléctrico. Esta polarización
permite que las moléculas del mismo compuesto se atraigan entre si por fuerzas
electrostáticas de distinta intensidad.
Por el contrario, cuando átomos de un mismo elemento no metálico se unen
covalentemente, su diferencia de electronegatividad es cero y no se crean dipolos.Las
moléculas entre sí poseen prácticamente una atracción nula.

ENLACE METALICO
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre
núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras
muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales
como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica
centrada en las caras o la cúbica centrada en el cuerpo.
En este tipo de estructura cada átomo metálico está dividido por otros doce átomos (seis
en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja
electronegatividad que poseen los metales, los electrones de valencia son extraídos de
sus orbitales. Este enlace sólo puede estar en sustancias en estado sólido.1
Los metales poseen algunas propiedades características que los diferencian de los
demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y
tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte,
primario, que se forma entre elementos de la misma especie. Al estar los átomos tan
cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas,
empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de
tales nubes. Estos electrones libres son los responsables de que los metales presenten
una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con
facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente
presentan brillo y son maleables. Los elementos con un enlace metálico están
compartiendo un gran número de electrones de valencia, formando un mar de electrones
rodeando un enrejado gigante de cationes.

ENLACE IONICO:
En Química, un enlace iónico o electrovalente es la unión de átomos que resulta de la
presencia de atracción electrostática entre los iones de distinto signo, es decir, uno
fuertemente electropositivo (baja energía de ionización) y otro fuertemente
electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los
átomos capta electrones del otro. La atracción electrostática entre los iones de carga
opuesta causa que se unan y formen un compuesto químico simple, aquí no se fusionan;
sino que uno da y otro recibe. Para que un enlace iónico se genere es necesario que la
diferencia (delta) de electronegatividades sea más que 1,7.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad,
este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una
transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El
metal dona uno o más electrones formando iones con carga positiva o cationes con una
configuración electrónica estable. Estos electrones luego ingresan en el no metal,
originando un ion cargado negativamente o anión, que también tiene configuración
electrónica estable. Son estables pues ambos, según la regla del octeto o por la
estructura de Lewis adquieren 8 electrones en su capa más exterior (capa de valencia),
aunque esto no es del todo cierto ya que contamos con varias excepciones.

video de los enlaces y tipos de enlaces, dar clic en el link.https://www.youtube.com/watch?v=85XmStwDdJo
UNIDAD II
BASES DEL LENGUAJE QUIMICO:
Resultados a parender en esta unidad es utilizar correctamente el lenguaje quimico en la formulacion e identificacion de sustancias quimicas.
2.1- COMPUESTOS INORGÁNICOS.
NUMERO DE OXIDACION:
el numero de oxidacion es un numero entero que representa el numero de electrones que
un atomo recibe (signo menos) o que pone a disposicion de otros ( signo mas)
cuando forman un compueston determinado.
eso significa que el numero de oxidacion es positivo si el atomo pierde electrones, o lo
comparte con un atomo que tenga tendencias a captarlos y sera negativo cuando el
atomo gane electrones o los comparte con un atomo que tenga tendencias a cederlos.
TABLA DE VALENCIAS DE LOS ELEMENTOS QUIMICOS
un compuestos es una sustancias formada por la unión de dos o mas elementos de
la tabla periódica una característica esencial es que tiene una formula química los
compuestos químicos son aquellas sustancias que están compuestas por la unión
de al menos dos elementos incluidos en la tabla periódica los compuestos
químicos pueden ser clasificados en los siguientes grupos.
Óxidos básicos: están conformados por oxígeno y un metal.
Óxidos ácidos: estos compuestos, en cambio, están formados por oxígeno y un no mental.
Hidruros: estos compuestos pueden ser no metálicos o metálicos y sus componentes son
hidrógeno y algún otro elemento
Hidrácidos: son aquellos hidruros no metálicos que al ser disueltos en agua se tornan
ácidos y están compuestos por hidrógeno y otro elemento.
Hidróxidos: compuestos por agua y algún óxido básico cuya reacción se caracteriza por
contar con el grupo oxidrilo.
Oxácidos: están compuestos por oxígeno, un no metal e hidrógeno y se obtienen a partir
de la reacción de agua y un óxido ácido
Oxisales: compuestas por la reacción de un hidróxido y un oxácido
Sales binarias: compuestos por un hidróxido y un hidrácido.
REGLAS PARA FORMAR COMPUESTOS
El hidrógeno (H) presenta número de oxidación +1 con los no metales y –1 con los
metales.
El oxígeno (O) presenta el número de oxidación –2, excepto en los peróxidos donde
es –1.
El compuesto se lee de derecha a izquierda
Se intercambian las valencias, pero prescindiendo del signo
Siempre que sea posible se simplifica:
Cu2S2 --> CuS
En cualquier formula química se escribe en primer lugar los elementos situados a la
izquierda de la tabla periódica (menos electronegativos) y en segundo lugar, los situados a
la derecha (mas electronegativos).
SISTEMAS DE NOMENCLATURA.
para nombrar los compuestos químicos inorgánicos se siguen las normas de la IUPAC
(union internacional de química pura y aplicada). se aceptan tres tipos de nomenclaturas
para los compuestos inorgánicos la sistemática y la nomenclatura stock y tradicional.
Hay tres tipos de nomenclatura las cuales son las siguientes:
- Nomenclatura sistemática ( propuesta por la IUPAC)
- Nomenclatura stock
- Nomenclatura tradicional (el sistema mas antiguo)
IUPAC: unión internacional de química pura y aplicada (international union of pure and
applied chemistry IUPAC)
NOMENCLATURA SISTEMATICA:
para nombrar compuetos quimicos segun esta nomenclatura se utilizan los prefijos:
MONO_, DI_, TRI_, TETRA_, PENTA_, HEXA_; HEPTA_.......
ejemplos
Ej. Fe2O3 ----------- Trióxido de dihierro
Ej. PH3 -------------- Trihidruro de fósforo
Ej. Ba(OH)2 -------- Dihidróxido de bario
NOMENCLATURA STOCK:
en este tipo de nomenclatura, cuando el elementos que forma el compuesto tiene
mas de una valencia esta esta indicada al final en numeros romanos y entre
parentesis:
ejemplo:
Ej. Fe2O3 ---------- Óxido de hierro (III)
Ej. PH3 ----------- Hidruro de fósforo (III)
Ej. Ba(OH)2 -------- Hidróxido de bario (II)
NOMENCLATURA TRADICIONAL:
En este tipo de nomenclatura para poder distinguir con que valencia funcionan los
elementos en ese compuestos se utilizan una serie de prefijos y sufijos.
ejemplos:
1 VALENCIA ------------ -ico
2 VALENCIAS ---------- -oso/-ico
3 VALENCIAS ---------- hipo…oso/-oso/-ico
4 VALENCIAS ---------- hipo…oso/-oso/-ico/per…ico
Ej. Fe2O3 ----------- Óxido férrico
Ej. PH3 -------------- Hidruro fosforoso
Ej. Ba(OH)2 -------- Hidróxido bárico
ÓXIDOS
son compuestos binarios formados por la combinación de un elemento y oxigeno, hay dos
clases de óxidos que son los óxidos básicos y los óxidos ácidos (anhídridos).
OXIDOS BASICOS.
son compuestos formados por la combinacion de un metal y el oxigeno. su formula general
es :
M2 + O
Donde M es el metal y x la valencia del metal ( el 2 corresponde a la valencia del oxigeno)
Compuesto Sistemática stock tradicional
FeO monoxido de hierro oxido de hierro (II) oxido ferroso
Fe2O3 trioxido de di hierro oxido de hierro (III) oxido ferrico
Li2O oxido de dilitio oxido de litio oxido de litio
OXIDO ACIDOS O ANHIDRIDOS.
Son compuestos binarios formados por un no metal y oxigeno. su formukla general
es:
NM + O
Donde NM, es el no metal y la x la valencia del no metal ( el 2 corresponde a la
valencia del oxigeno) las valencias de los elementos se intercambian entre ellos y se
ponen como subindices.( si la valencia es par se simplifica)
Compuesto Sistemática stock tradicional
SO monoxido de azufre oxido de azufre anhidrido hiposulfuroso
SO2 dióxido de azufre óxido de azufre (IV) Anhídrido sulfuroso
SO3 trióxido de azufre óxido de azufre (VI) Anhídrido sulfúricO
CO2 dióxido de carbono óxido de carbono (IV) Anhídrido carbónico
PERÓXIDOS:
Se caracterizan por llevar el grupo peroxo ( - o - o -) también representado O-1,
los podemos considerar como óxidos con mas oxígenos del que corresponde por
la valencia de este.
En estos compuestos el oxígeno actúa siempre con el número de oxidación -1. Por
tanto, el elemento que se combina con él tiene que utilizar un número de oxidación
positivo.
ejemplo:
H2O2 PERÓXIDO DE HIDRÓGENO
NA2O2 PERÓXIDO DE SODIO
CAO2 PERÓXIDO DE CALCIO
COMPUESTOS BINARIOS: ÓXIDOS SALINOS
Resultan de unir o combinar 2 Óxidos simples de un solo elemento. Son Óxidos
Binarios o también llamados Mixtos
Compuesto Sistemática Stock Tradicional
Co3O4
Tetraóxido de tricobalto
óxido de cobalto (II, III)
oxido Salino de Cobalto.
Óxido doble deCobalto
Óxido mixto de cobalto
COMPUESTOS BINARIOS: HIDRUROS
Son combinaciones del hidrógeno con cualquier elemento químico
Hidruros metálicos: es la combinación del hidrógeno (-1) con un metal
son compuestos binarios formados por u metal e hidrógeno. su formula general es:
M + H
Compuesto Sistemática Stock Tradicional
CaH2 dihidruro de calcio hidruro de calcio hidruro cálcico
LiH hidruro de litio hidruro de litio hidruro lítico
FeH3 trihidruro de hierro hidruro de hierro (III) hidruro férrico
SrH2 dihidruro de estroncio hidruro de estroncio hidruro de estroncio
COMPUESTOS BINARIOS: HIDRUROS NO METÁLICOS (HIDRÁCIDOS)
Hidrácidos: es la combinación del hidrógeno con un no metal (de la primera o
segunda familia). El H tiene valencia +1
COMPUESTOS ESPECIALES
Los hidruros que surgen de combinar el hidrógeno con un no metal (de la tercera o
cuarta familia), se nombran de forma especial
COMPUESTOS TERNARIOS: HIDRÓXIDOS
Los hidróxidos son compuestos constituidos por tres elementos: un metal, oxígeno
e hidrógeno. En los hidróxidos metálicos el oxígeno y el hidrógeno se encuentran
formando uno o más grupos OH (grupos hidroxilo).
Hidróxidos: se pueden formar de dos maneras:
Óxido + H2O
Metal + (OH) (valencia -1).
COMPUESTOS TERNARIOS: OXÁCIDOS
Son compuestos ternarios formados por un no metal, oxígeno e hidrógeno. Se obtienen a partir del óxido ácido o anhídrido correspondiente sumándole una molécula de agua (H2O).
SO3 (s) + H2O(l) = H2SO4 (ac)
N2O5 (g) + H2O(l) = 2HNO3 (ac)
P4O10 (s) + H2O(l) = 4 H3PO4 (ac)
PROYECTO DE AULA
TIPOS DE ENERGIA Y SUS CAMBIOS
ENERGÍAS
TIPOS DE ENERGÍA
La energía es la capacidad que tiene un cuerpo de producir un trabajo o de producir
cambios en las cosas. La energía no es materia, no ocupa espacio ni puede percibirse por
los sentidos. Lo que si podemos percibir son sus manifestaciones o efectos.
Hay distintas formas o manifestaciones de la energía:
Energía luminosa:
Como su nombre lo indica, proviene de la luz solar. El sol emite rayos luminosos y la
actividad de la Tierra se mantiene por la acción de la energía luminosa del Sol. La energía
luminosa está presente en el origen de la mayoría de los fenómenos que observamos. El
día y la noche existen por la proyección de los rayos del Sol sobre la Tierra que está
girando sobre sí misma. También hablamos de energía luminosa aquellas de otras fuentes
como una bombilla.
Energía térmica:
La energía térmica es un tipo de energía liberada en forma de calor como la que se
desprende de objetos calientes como el Sol, una estufa, y cosas que arden en general. La
energía térmica también es conocida por energía calórica o calorífica. La energía térmica
interviene en los procesos caloríficos que consiste en dos cuerpos de diferentes
temperaturas se ponen en contacto, la energía que se transmite de cuerpo a cuerpo
producto de las diferencias de temperaturas es lo que se denomina energía térmica.
Energía mecánica:
La energía mecánica es la energía que presentan los cuerpos en razón de su movimiento
(energía cinética), de su situación respecto de otro cuerpo, generalmente la tierra, o de sus
estado de deformación, en el caso de los cuerpos elásticos. Es decir, la energía mecánica
es la suma de la energía potencial (energía almacenada en un sistema), cinética (energía
que surge en el mismo movimiento) y la elástica de un cuerpo en movimiento.
Energía eléctrica:
La energía eléctrica es la forma de energía que resulta de la existencia de una diferencia
de potencial entre dos puntos, situación que permitirá establecer una corriente eléctrica
entre mambos puntos si se los coloca en contacto por intermedio de un conductor eléctrico
para obtener el trabajo mencionado. Esta energía es capaz de transformarse en
muchísimas otras formas de energía como la luminosa térmica y mecánica. Está presente
en un rayo o en la energía eléctrica de las viviendas.
Energía química:
La energía química es otra de las manifestaciones de la energía y específicamente se trata
de la energía interna que posee un determinado cuerpo y si bien siempre se podrá
encontrar en la materia, solo se nos mostrará cuando se produzca una alteración
importante de ésta. Poniéndolo en términos más sencillos, la energía química es aquella
que está producida por reacciones químicas. Entre los ejemplos más cotidianos que
podemos dar de energía química se cuentan: la energía que emana del carbón cuando
este se quema, las pilas, las baterías, entre otros.
Energía nuclear:
La energía nuclear es aquella que se libera, ya sea de manera espontánea o artificial, en
las reacciones nucleares. A la energía nuclear se la obtiene básicamente a través de dos
maneras, por el proceso de la fisión y fusión nuclear.
Energía hidráulica:
La energía hidráulica es aquella energía que es generada gracias a la utilización de la
fuerza que emana o disponen las corrientes de agua, entre otras, las mareas o los saltos
de agua.
Energía eólica:
La energía eólica es la energía que se obtiene a partir del soplado del viento; las fuertes
corrientes de aire transforman la energía en otras expresiones muy útiles para llevar a
cabo las diferentes actividades humanas.
Energía electromagnética:
La energía electromagnética es la cantidad de energía almacenada en una región del
espacio que podemos atribuir a la presencia de un campo electromagnético, y que se
expresará en función de las intensidades del campo magnético y campo eléctrico.
CAMBIOS DE ENERGÍA
En la naturaleza la energía está sometida a cambios continuos y se transforma de una a
otra forma. Así el calor del sol se transforma en energía mecánica cuando el calentamiento
del aire da lugar a los vientos. También el sol provoca calentamiento del agua, su
evaporación y es el responsable del ciclo del agua.
Gracias a la luz del sol, las plantas realizan la fotosíntesis transformando la energía
luminosa en energía química. Los seres vivos, como nosotros mismos, transformamos la
energía química de los alimentos en energía mecánica cuando nos movemos. El mismo
sol contiene energía nuclear que es continuamente transformada en luz y calor.
Los combustibles son sustancias que almacenan gran cantidad de energía química. Son
combustibles la gasolina, el butano, el gas natural, el carbón, la madera, etc. Cuando estas
sustancias reaccionan con el oxígeno decimos que se produce una combustión o que se
“queman” produciendo luz y calor. En estas combustiones también se producen gases que
al expandirse producen gran cantidad de energía mecánica, es así como funcionan los
motores de explosión de los coches.
Obtención de otras energías a partir de la energía eólica
La energía eólica es una energía abundante y renovable de la naturaleza. Proviene de la
conversión de la energía cinética que traen las masas de aire en movimiento hacia energía
mecánica y luego a energía eléctrica. En esta conversión se utilizan máquinas llamadas
aerogeneradores. Estos dispositivos, a través de una superficie aerodinámica expuesta al
viento, producen trabajo mecánico en un eje. Presentan diseños aerodinámicos para
adaptar distintos tipos de aerogeneradores a las condiciones climáticas de cada zona.
La energía contenida en el viento debe ser transformada, según sea la necesidad, en
energía eléctrica, mecánica o térmica. Las posibilidades de uso de la energía eléctrica son
infinitas. La energía mecánica obtenida del viento puede ser utilizada para el bombeo de
agua o molienda de distintos productos. La energía térmica se consigue a partir de la
energía eólica puede ser usada para generar frío o calor, para procesos industriales.
Obtención de energía eléctrica a partir de la energía química
El fundamento de las pilas y acumuladores, es la transformación de la energía química en
eléctrica, mediante reacciones de oxidación-reducción producidas en los electrodos, que
generan una corriente de electrones. Cuando se unen mediante un hilo metálico dos
cuerpos entre los cuales existe una diferencia de potencial, se produce un paso de
corriente que provoca la disminución gradual de dicha diferencia. Al final, cuando el
potencial se iguala, el paso de corriente eléctrica cesa. Para que la corriente siga
circulando debe mantenerse constante la diferencia de potencial.
En la actualidad, la energía química es la que mueve los automóviles, los buques y los
aviones y, en general, millones de máquinas. Tanto la combustión del carbón, de la leña o
del petróleo en las máquinas de vapor como la de los derivados del petróleo en el estrecho
y reducido espacio de los cilindros de un motor de explosión, constituyen reacciones
químicas.
La energía es una propiedad inherente a la materia. La materia posee energía almacenada
que se debe, por una parte, a la posición o a la altura de un cuerpo (energía cinética) y, por
otra, a la naturaleza o las sustancias de que esté hecho el cuerpo al que se hace
referencia, ya que a cada elemento o compuesto le corresponde cierta cantidad de energía
química almacenada a la que se le denomina contenido energético. Cuando se lleva acabo
un fenómeno químico, éste va acompañado por una manifestación de energía, ya sea que
haya absorción o desprendimiento de ella, debido a la energía química que almacenan las
sustancias
Lo anterior significa que, cuando la energía química almacenada de los reactivos es mayor
que la energía de los productos, hay un excedente de energía que se libera, pues la
energía se mantiene constante, es decir, no se crea ni se destruye.
La base científica de la batería con limones
El fundamento de las pilas y acumuladores es la transformación de la energía química en
eléctrica, mediante reacciones de oxidación-reducción producidas en los electrodos, que
generan una corriente de electrones.
Cuando se unen mediante un hilo metálico dos cuerpos entre los cuales existe una
diferencia de potencial, se produce un paso de corriente que provoca la disminución
gradual de dicha diferencia. Al final, cuando el potencial se iguala, el paso de corriente
eléctrica cesa. Para que la corriente siga circulando debe mantenerse constante la
diferencia de potencial.
Funcionamiento de una pila electroquímica
El funcionamiento de una pila es sencillo, consiste básicamente en introducir electrones en
uno de los extremos de un alambre y extraerlos por el otro. La circulación de los electrones
a lo largo del alambre constituye la corriente eléctrica. Para que se produzca, hay que
conectar cada extremo del alambre a una placa o varilla metálica sumergida en un
electrolito que suele ser una solución química de algún compuesto iónico.
Cuando ese compuesto se disuelve, las moléculas se dividen en iones positivos y
negativos, que se mantienen separados entre sí por efecto de las moléculas del líquido. El
electrolito que utilizó Volta era ácido sulfúrico; cada una de sus moléculas, al disolverse en
agua, se descompone en dos protones H+ (iones positivos) y un ion sulfato SO4- (ion
negativo).
Las varillas metálicas de cobre y cinc constituyen los electrodos, que deben ser
sumergidos en el electrolito sin que lleguen a entrar en contacto. La placa de cobre es el
electrodo positivo o ánodo y la placa de cinc el electrodo negativo o cátodo.
Al reaccionar el electrolito con las varillas se produce una transmisión de electrones, que
han sido extraídos de la placa de cinc, hacia la placa de cobre, con lo que los átomos de
cinc son oxidados e incorporados a la disolución, según la reacción:
Zn?> Zn2++ 2e-
Esto ocurre así y no al revés, del cobre al cinc, porque los átomos de cinc tienen más
tendencia que los de cobre a ceder electrones.
En la varilla de cobre se produce una reducción de los iones hidrógeno H+ de la disolución,
ya que los electrones liberados por los átomos de cinc recorren el hilo conductor hacia la
placa de cobre y son captados por los H+, que se convierten en átomos de hidrógeno y
escapan en forma de gas. Estos electrones en movimiento son los que originan la corriente
eléctrica.
Por su parte, los iones SO4- reaccionan con los cationes Zn2+ y se convierten en
moléculas de sulfato de cinc.
2 H~+2e —> H2
Zn2+ + SO42- —> ZnSO4
Cuando se corta la conexión exterior entre las placas, los electrones no pueden
desplazarse a lo largo del hilo de una placa a otra, con lo que se interrumpe la reacción.
El dispositivo funciona mientras existan átomos de cinc para formar el sulfato
correspondiente. Cuando la placa de cinc se ha desintegrado por completo ya no puede
producirse la reacción, por lo que la pila ya no tiene uso. Por este motivo, las pilas de este
tipo reciben el nombre de pilas primarias.
Obtención de energía eléctrica mecánica.
Vamos a planear el siguiente proyecto de impulsar un vehículo de cuatro ruedas en el que
vamos a utilizar un tipo de energía diferente al que se obtiene directamente de una batería
de 9 Voltios.
Para llevar lo acabo necesitamos aplicar:
Método científico.
Aplicando la obtención de energías existentes en la actualidad antes mencionado
impulsaremos un vehículo de miniatura de cuatro ruedas.
1. Observación del Problema:
La falta de una fuente de energía para mover el vehículo.
2. Hipótesis:
a. El vehículo no se puede moverse por la falta de fuerza que lo impulsará.
b. Con qué tipo de energía el vehículo podrá moverse.
c. El diseño del vehículo será el apropiado por su tamaño y peso.
3. Experimentación:
Primero experimento(literal a), se construye un vehículo con materiales fáciles de adquirir
en casa, una botella de agua, cuatro tapas de Botellones de agua de galón, palillos chinos,
pistola con silicona, tijeras, cinta adhesiva, hoja de sierra, estilete un motor de juguete y
unas hélices elaboradas con plástico de botella.
Una vez ya ensamblado el vehículo se verifica que las hélices estén conectada como
estructura con el motor para que cuando este reciba la energía haga girar las hélices
dándole impulso al vehículo.
Se posiciona los limones en el vehículo conectados en paralelo verificando primero su
voltaje en el que marca 2.35 V., al realizar las pruebas los limones no pueden hacer mover
al motor. Realizando un poco más de investigación los limones no pueden llevar a cabo la
tarea de hacer mover el motor por el amperaje que no es el necesario.
Segundo experimento (literal b), se investiga un poco más en el diseño del vehículo y se
determina que se debe rediseñar el mismo para poder perder peso en su masa y se
determina que hay que generar la energía de otra forma.
Se arma el otro vehículo con los siguientes materiales: Tijeras de Aluminio, estilete, pistola
de silicona, tijeras normales, playo, destornillador fino, palillos de helados, sorbetes,
borrador, pegamento transparente, palillos chinos regla, ligas, plástico de botellas, cartón
de base de vehículo y cartón para carrocería.
Se ensambla el vehículo.

Se construye dos puntos lejanos en el que la liga va instalada de tal manera que el primer
punto la liga queda anclada y el segundo punto la liga va a enrollarse en el eje de las
llantas para que almacene energía dentro de la goma, esta energía contenida tiene que
gastarse de cualquier manera por lo que se procede a eliminarla desenrollándola y a su
vez esto añade revoluciones al eje de las llanta provocando la energía mecánica para
impulsar el vehículo. Luego de esta fuerza ejercida en el vehículo se produce la energía
cinética que es el movimiento del vehículo en desplazamiento por su masa.
El vehículo recorre una distancia de 5.45 m.
4. Conclusión:
El segundo experimento realizado pudo impulsar el vehículo empezando con la energía potencial elástica de la liga que al enrollarse en su parte trasera de las llantas acumuló energía y al desenrollarse produce una energía mecánica que impulsa al vehículo dando paso a la energía cinética que le proporciona al vehículo velocidad y distancia en función a su masa o peso.
video sobvre los tipos de energia, dar clic en el link
SEGUNDO PROYECTO ADICIONAL
Cambio de energía Química a eléctrica
En el presente cambio de energía hemos utilizado como punto referencial a los limones ya que
estos generan energía química gracias a su acidez la cual por medio de 2 metales podremos
hacer que puedan encender una bombilla led.
Materiales a utilizar:
3 limones de preferencia verdes
Alambre de cobre.
Lagartos.
Led (diodo emisor de luz)
Metales (zinc y cobre)
En este experimento consiste en insertar en diversos limones, dos objetos hechos de metales
diferentes, por ejemplo un clavo galvanizado de zinc también denominado zincado (
zincado proceso de deposición electrolítica en baños similar al cromado o cobreado), y
una moneda o lamina de cobre. Estos dos objetos funcionan como electrodos, causando una
reacción electroquímica mediada por el jugo de limón que genera una pequeña cantidad
de energía de corriente eléctrica.
Objetivo del experimento:
Demostrarle a los estudiantes como es el funcionamiento de una pila mediante los limones,
después de que la pila esta ensamblada se puede utilizar un multímetro o voltimetro para
asi poder confirmar si existe voltaje determinado que usualmente no supera 1v y una
corriente aproximada de 0,1 ma como máximo. El voltaje y corriente producido es
insuficiente para lograr encender un led, para lo que se requeriría una batería hecha de
varias pilas de limón.
Se necesitan al menos dos pilas conectadas en serie para duplicar el voltaje y varias conectadas
en paralelo para alcanzar corrientes del orden de 5ma, de esta forma se podrá encender
un diodo led de bajo voltaje.
Reacciones químicas:
Una pila eléctrica es un dispositivo que convierte energía química en energía eléctrica por un
proceso químico transitorio por el cual cesa su actividad y han de renovarse sus
elementos constituyentes puesto que sus características resultan alteradas durante el mismo. Se
trata de un generador primario por el cual esta energía resulta accesible mediante dos
terminales que tiene la pila, llamados polos, electrodos o bornes. Uno de ellos es el polo
negativo (ánodo) y el otro es el polo positivo (cátodo), la estructura fundamental de una
pila consiste en dos electrodos, metálicos en muchos caso introducidos en una disolución
conductora de electricidad.
Técnicamente ocurren la oxidación y la reducción.
En el ánodo el zinc es oxidado
Zn zn2 + 2e
En el cátodo se reducen los iones de hidrogeno presentes en la batería
2h + 2e = h2
Los voltajes y corrientes alcanzados dependen críticamente de los limones ya sea su acidez, el
tamaño y metal de los objetivos usados.
VER VIDEO DE COMO SE FABRICA UNA PILA CON LIMONES DAR CLIC EN EL LINK
La configuración electrónica de un átomo es una designación de la distribución de los
electrones entre los diferentes orbitales, en las capas principales y las subcapas. La
notación de la configuración electrónica utiliza los símbolos de subcapa (s, p, d y f) y cada
uno con un superíndice que indica el número de electrones en ese subnivel.
Por ejemplo para el Li el cual tiene 3 electrones sería, 1s2 2s1; el número que se encuentra
al lado de la subcapa es n, la letra representa el subnivel y el superíndice el número de
electrones en ese subnivel.
TIPOS DE CONFIGURACIÓN ELECTRÓNICA
Para graficar la configuración electrónica existen cuatro modalidades, con mayor o menor
complejidad de comprensión, que son:
Configuración estándar: Se representa la configuración electrónica que se obtiene usando
el cuadro de las diagonales. Es importante recordar que los orbitales se van llenando en el
orden en que aparecen, siguiendo esas diagonales, empezando siempre por el 1s.
Aplicando el mencionado cuadro de las diagonales la configuración electrónica estándar,
para cualquier átomo, es la siguiente:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
6p6 7s2 5f14 6d10 7p6
Configuración condensada: Los niveles que aparecen llenos en la configuración estándar
se pueden representar con un gas noble (elemento del grupo VIII), donde el número
atómico del gas coincida con el número de electrones que llenaron el último nivel. Los
gases nobles son He, Ne, Ar, Kr, Xe y Rn.
empleando flechas para simbolizar el spin de cada uno. El llenado se realiza respetando el
principio de exclusión de Pauli y la Regla de máxima multiplicidad de Hund.
Configuración semidesarrollada: Esta representación es una combinación entre la
configuración condensada y la configuración desarrollada. En ella sólo se representan
los electrones del último nivel de energía.
los electrones del último nivel de energía.
EJEMPLO DE CONFIGURACION ELECTRONICA
Configuración electrónica del Ra: Z = 88 quiere decir que
tiene 88 e-
La
configuración electrónica es:
1 s2 2 s2 p6 3 s2 p6 d10 4s2 p6 d10 f14 5s2 p6 d10 6 s2 p6 7 s2
NÚMEROS CUÁNTICOS
1) NÚMERO CUÁNTICO PRINCIPAL (n)
Representa los niveles energéticos.
Se designa con números enteros positivos desde
n=1 hasta n=7 para los elementos
conocidos.
2) NÚMERO CUÁNTICO SECUNDARIO O
AZIMUTAL ( l )
Determina el subnivel y se
relaciona con la forma del orbital.
Cada
nivel
energético ( n ) tiene "n" subniveles.Se relaciona con el giro del electrón sobre su propio eje. Al estar juntos en un mismo
orbital, un electrón gira hacia la derecha y otro hacia la izquierda. Se le asignan
números fraccionarios: -1/2 y +1/2
3) NÚMERO CUÁNTICO MAGNÉTICO (m)
Representa los
orbitales presentes en un subnivel.

4) NÚMERO CUÁNTICO POR SPIN
(s)
orbital, un electrón gira hacia la derecha y otro hacia la izquierda. Se le asignan
números fraccionarios: -1/2 y +1/2
video sobre numeros cuanticos y configuracion electronica, dar clic en el link.https://www.youtube.com/watch?v=eDYGmDpNHaU
1.4 TABLA PERIÓDICA DE LOS ELEMENTOS
La Tabla Periódica de Elementos Químicos clasifica, organiza y distribuye los distintos
elementos químicos, conforme a sus propiedades y características. La misma se le
atribuye al químico ruso Dimitri Ivanovich Mendeléiev, quien ordenó los elementos
basándose en la variación manual de las propiedades químicas, si bien Jullius Lothar
Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las p
ropiedades físicas de los átomos. La forma actual es una versión modificada de la de
Mendeléiev, fue diseñada por Alfred Werner.
Descripción: Los elementos se hallan distribuidos:
En 7 filas denominadas (periodos).
En 18 columnas o familias, las cuales se ordenan en grupos; 8 grupos A y 8 grupos B.
PERIODOS: Son las filas horizontales, nos indican el último nivel de energía del
elemento. Existen 7 periodos o niveles.
Periodo 1, 2 y 3, formados por 2, 8 y 8 elementos respectivamente, son denominados
Periodos cortos.
Periodos 4, 5 y 6 son los Periodos largos, el 7º periodo se halla incompleto.
el propio lavoisier dio la primera clasificación de elementos agrupando los mismo:
metales, no metales y metaloides o metales de transicion.
LOS METALES
sus propiedades fisicas son:
la mayoria son solidos
conductividad
brillo
dureza
maleabilidad y ductibilidad
el Hg es liquido
el Fe, Ni y Co presentan magnetismo.
PROPIEDADES QUIMICAS:
reactividad, facilidad y velocidad con la que un elemento se combina con otro para formar
un compuesto.
un compuesto.
CARACTERISTICAS:
sus atomos estan ordenados de forma compacta formando cristales
tienden a perder el ultimo orbital.
METALES EN LA TABLA PERIODICA
los metales en grupo tiene propiedades similares, la reactividad de los metales tienden a
disminir al movernos de izquierda a derecha en la tabla periodica.
disminir al movernos de izquierda a derecha en la tabla periodica.
metales alcalinos GRUPO 1
son del Li, Fr, reaccionan con otros elementos perdiendo 1 e-
son los mas reactivos entre los metales
presentan baja dureza
los mas importantes son el Na y el K.
Metales alcalinotérreos: Grupo II
Ligeramente duros
Buenos conductores de electricidad
Reaccionan perdiendo dos electrones
Son menos reactivos que los metales alcalinos.
Los más importantes son el Ca y el Mg
Metales de transición
•Elementos del grupo 3
al 12
•Son duros y brillosos
•Son buenos conductores
de la electricidad
•Los más comunes son:
el Fe, Cu, Ni, Ag y Au
Metales del Grupo 13 al 15
Son los de menor reactividad de entre los metales.
Los de mayor utilidad son el Al, por ser de peso ligero, que se utiliza en piezas de aeroplanos;
el Sn, que se utiliza en fabricación de pinturas y tintas; y, el Pb, que se utiliza en las baterías
de automóviles.
Lantánidos
Son llamados elementos de transición interna
Son suaves, maleables
Presentan brillo y una alta conductividad
Se mezclan con elementos comunes para formar aleaciones
Se encuentran en abundancia en la corteza terrestre, en minerales como la monacita.
Actínidos
Son llamados elementos de transición interna
Son en total 15 y tienen periodos cortos de vida
Son isótopos radioactivos
Solo el Ac, Th, Pa y U se encuentran de manera natural.
El uranio se utiliza para producir energía en plantas nucleares
Propiedades Físicas
El C, I y S, son sólidos a temperatura ambiente.
El Br es el único no metal que es líquido a temperatura ambiente
Tienen puntos de fusión muy bajos y baja densidad
Características
Los átomos de los no metales, generalmente gana o comparten electrones
Son malos conductores del calor y la electricidad
CLASIFICACION DE LOS NO METALES SEGUN SUS FAMILIAS
HALÓGENOS
Son formadores de sales
Son muy reactivos
El cloro se utiliza para eliminar bacterias en el agua y vegetales
ANFÍGENOS
También llamado familia del oxígeno y es el grupo 16 (formado por los siguientes elementos:
(O), (S), (Se), (Te) y (Po).
El nombre de anfígeno en español deriva de la propiedad de algunos de sus elementos de
formar compuestos con carácter ácido o básico.
El oxígeno y el azufre se utilizan abiertamente en la industria
El telurio y el selenio en la fabricación de semiconductores
NITROGENOIDES
Esta familia está compuesta por los elementos químicos del grupo 15: N, P, As, Sb y Bi.
A altas temperaturas son muy reactivos
CARBONOIDES
La mayoría de los elementos de este grupo son muy conocidos y difundidos, especialmente el
carbono, elemento fundamental de la química orgánica.
El silicio es uno de los elementos más abundantes en la corteza terrestre (28%), y de gran
importancia en la sociedad a partir del siglo XX ya que es el elemento principal de los circuitos
integrados.
METALOIDES
CLASIFICACION
Propiedades Físicas
Son buenos conductores de la electricidad
El Si, Ge y As son utilizados para fabricar semiconductores
Propiedades Químicas
Reactividad, es variada, algunos son más reactivos que otros
Se los usa en las industrias acerera, agrícola, minería y en la producción de gas acetileno
Características
Son 7 elementos cuyas características son intermedias entre los metales y no metales
Sólidos a temperatura ambiente
VIDEO SOBRE LA CLASIFICACIÓN DE LA TABLA PERIÓDICA,DAR CLIC EN EL LINK
https://www.youtube.com/watch?v=ubtk60kUZjU
ENLACES Y TIPOS DE ENLACES
Los ENLACES son las uniones entre átomos para formar moléculas. Siempre que
existe una molécula es porque ésta es más estable que los átomos que la forman por
separado. A la diferencia de energía entre estos dos estados se le denomina energía
de enlace.
Generalmente, los átomos se combinan en proporciones fijas para dar moléculas. Por
ejemplo, dos átomos de hidrógeno se combinan con uno de oxígeno para dar una
molécula de agua. Esta proporción fija se conoce como estequiometria.
existe una molécula es porque ésta es más estable que los átomos que la forman por
separado. A la diferencia de energía entre estos dos estados se le denomina energía
de enlace.
Generalmente, los átomos se combinan en proporciones fijas para dar moléculas. Por
ejemplo, dos átomos de hidrógeno se combinan con uno de oxígeno para dar una
molécula de agua. Esta proporción fija se conoce como estequiometria.
TIPOS DE ENLACES
ENLACE COVALENTE
ENLACE METÁLICO
ENLACE IONICO
ENLACE COVALENTE
Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para
alcanzar el octeto estable, compartiendo electrones del último nivel2 (excepto el
Hidrógeno que alcanza la estabilidad cuando tiene 2 electrones). La diferencia de
electronegatividad entre los átomos no es lo suficientemente grande como para que se
produzca una unión de tipo iónica. Para que un enlace covalente se genere es
necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7.
De esta forma,los dos átomos comparten uno o más pares electrónicos en un nuevo
tipo de orbital, denominado orbital molecular. Los enlaces covalentes se producen
entre átomos de un mismo elemento no metal y entre distintos elementos no metales.
Cuando átomos de distintos no metales se unen en forma covalente, uno de ellos
resultará más electronegativo que el otro, por lo que tenderá a atraer la nube
electrónica del enlace hacia su núcleo, generando un dipolo eléctrico. Esta polarización
permite que las moléculas del mismo compuesto se atraigan entre si por fuerzas
electrostáticas de distinta intensidad.
Por el contrario, cuando átomos de un mismo elemento no metálico se unen
covalentemente, su diferencia de electronegatividad es cero y no se crean dipolos.Las
moléculas entre sí poseen prácticamente una atracción nula.
alcanzar el octeto estable, compartiendo electrones del último nivel2 (excepto el
Hidrógeno que alcanza la estabilidad cuando tiene 2 electrones). La diferencia de
electronegatividad entre los átomos no es lo suficientemente grande como para que se
produzca una unión de tipo iónica. Para que un enlace covalente se genere es
necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7.
De esta forma,los dos átomos comparten uno o más pares electrónicos en un nuevo
tipo de orbital, denominado orbital molecular. Los enlaces covalentes se producen
entre átomos de un mismo elemento no metal y entre distintos elementos no metales.
Cuando átomos de distintos no metales se unen en forma covalente, uno de ellos
resultará más electronegativo que el otro, por lo que tenderá a atraer la nube
electrónica del enlace hacia su núcleo, generando un dipolo eléctrico. Esta polarización
permite que las moléculas del mismo compuesto se atraigan entre si por fuerzas
electrostáticas de distinta intensidad.
Por el contrario, cuando átomos de un mismo elemento no metálico se unen
covalentemente, su diferencia de electronegatividad es cero y no se crean dipolos.Las
moléculas entre sí poseen prácticamente una atracción nula.
ENLACE METALICO
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre
núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras
muy compactas. Se trata de líneas tridimensionales que adquieren estructuras tales
como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica
centrada en las caras o la cúbica centrada en el cuerpo.
En este tipo de estructura cada átomo metálico está dividido por otros doce átomos (seis
en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja
electronegatividad que poseen los metales, los electrones de valencia son extraídos de
sus orbitales. Este enlace sólo puede estar en sustancias en estado sólido.1
Los metales poseen algunas propiedades características que los diferencian de los
demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y
tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte,
primario, que se forma entre elementos de la misma especie. Al estar los átomos tan
cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas,
empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de
tales nubes. Estos electrones libres son los responsables de que los metales presenten
una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con
facilidad si se ponen en contacto con una fuente eléctrica. Los metales generalmente
presentan brillo y son maleables. Los elementos con un enlace metálico están
compartiendo un gran número de electrones de valencia, formando un mar de electrones
rodeando un enrejado gigante de cationes.
ENLACE IONICO:
En Química, un enlace iónico o electrovalente es la unión de átomos que resulta de la
presencia de atracción electrostática entre los iones de distinto signo, es decir, uno
fuertemente electropositivo (baja energía de ionización) y otro fuertemente
electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los
átomos capta electrones del otro. La atracción electrostática entre los iones de carga
opuesta causa que se unan y formen un compuesto químico simple, aquí no se fusionan;
sino que uno da y otro recibe. Para que un enlace iónico se genere es necesario que la
diferencia (delta) de electronegatividades sea más que 1,7.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad,
este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una
transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El
metal dona uno o más electrones formando iones con carga positiva o cationes con una
configuración electrónica estable. Estos electrones luego ingresan en el no metal,
originando un ion cargado negativamente o anión, que también tiene configuración
electrónica estable. Son estables pues ambos, según la regla del octeto o por la
estructura de Lewis adquieren 8 electrones en su capa más exterior (capa de valencia),
aunque esto no es del todo cierto ya que contamos con varias excepciones.

son compuestos binarios formados por la combinación de un elemento y oxigeno, hay dos
clases de óxidos que son los óxidos básicos y los óxidos ácidos (anhídridos).
OXIDOS BASICOS.
son compuestos formados por la combinacion de un metal y el oxigeno. su formula general
es :
Compuesto Sistemática stock tradicional

presencia de atracción electrostática entre los iones de distinto signo, es decir, uno
fuertemente electropositivo (baja energía de ionización) y otro fuertemente
electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los
átomos capta electrones del otro. La atracción electrostática entre los iones de carga
opuesta causa que se unan y formen un compuesto químico simple, aquí no se fusionan;
sino que uno da y otro recibe. Para que un enlace iónico se genere es necesario que la
diferencia (delta) de electronegatividades sea más que 1,7.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad,
este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una
transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El
metal dona uno o más electrones formando iones con carga positiva o cationes con una
configuración electrónica estable. Estos electrones luego ingresan en el no metal,
originando un ion cargado negativamente o anión, que también tiene configuración
electrónica estable. Son estables pues ambos, según la regla del octeto o por la
estructura de Lewis adquieren 8 electrones en su capa más exterior (capa de valencia),
aunque esto no es del todo cierto ya que contamos con varias excepciones.
video de los enlaces y tipos de enlaces, dar clic en el link.https://www.youtube.com/watch?v=85XmStwDdJo
UNIDAD II
BASES DEL LENGUAJE QUIMICO:
Resultados a parender en esta unidad es utilizar correctamente el lenguaje quimico en la formulacion e identificacion de sustancias quimicas.
2.1- COMPUESTOS INORGÁNICOS.
NUMERO DE OXIDACION:
el numero de oxidacion es un numero entero que representa el numero de electrones que
un atomo recibe (signo menos) o que pone a disposicion de otros ( signo mas)
cuando forman un compueston determinado.
eso significa que el numero de oxidacion es positivo si el atomo pierde electrones, o lo
comparte con un atomo que tenga tendencias a captarlos y sera negativo cuando el
atomo gane electrones o los comparte con un atomo que tenga tendencias a cederlos.
TABLA DE VALENCIAS DE LOS ELEMENTOS QUIMICOS
un compuestos es una sustancias formada por la unión de dos o mas elementos de
la tabla periódica una característica esencial es que tiene una formula química los
compuestos químicos son aquellas sustancias que están compuestas por la unión
de al menos dos elementos incluidos en la tabla periódica los compuestos
químicos pueden ser clasificados en los siguientes grupos.
Óxidos básicos: están conformados por oxígeno y un metal.
Óxidos ácidos: estos compuestos, en cambio, están formados por oxígeno y un no mental.
Hidruros: estos compuestos pueden ser no metálicos o metálicos y sus componentes son
hidrógeno y algún otro elemento
Hidrácidos: son aquellos hidruros no metálicos que al ser disueltos en agua se tornan
ácidos y están compuestos por hidrógeno y otro elemento.
Hidróxidos: compuestos por agua y algún óxido básico cuya reacción se caracteriza por
contar con el grupo oxidrilo.
Oxácidos: están compuestos por oxígeno, un no metal e hidrógeno y se obtienen a partir
de la reacción de agua y un óxido ácido
Oxisales: compuestas por la reacción de un hidróxido y un oxácido
Sales binarias: compuestos por un hidróxido y un hidrácido.
ejemplo:
Ej. Fe2O3 ---------- Óxido de hierro (III)
Ej. PH3 ----------- Hidruro de fósforo (III)
Ej. Ba(OH)2 -------- Hidróxido de bario (II)
NOMENCLATURA TRADICIONAL:
En este tipo de nomenclatura para poder distinguir con que valencia funcionan los
elementos en ese compuestos se utilizan una serie de prefijos y sufijos.
ejemplos:
1 VALENCIA ------------ -ico
2 VALENCIAS ---------- -oso/-ico
3 VALENCIAS ---------- hipo…oso/-oso/-ico
4 VALENCIAS ---------- hipo…oso/-oso/-ico/per…ico
Ej. Fe2O3 ----------- Óxido férrico
Ej. PH3 -------------- Hidruro fosforoso
Ej. Ba(OH)2 -------- Hidróxido bárico
la tabla periódica una característica esencial es que tiene una formula química los
compuestos químicos son aquellas sustancias que están compuestas por la unión
de al menos dos elementos incluidos en la tabla periódica los compuestos
químicos pueden ser clasificados en los siguientes grupos.
Óxidos básicos: están conformados por oxígeno y un metal.
Óxidos ácidos: estos compuestos, en cambio, están formados por oxígeno y un no mental.
Hidruros: estos compuestos pueden ser no metálicos o metálicos y sus componentes son
hidrógeno y algún otro elemento
Hidrácidos: son aquellos hidruros no metálicos que al ser disueltos en agua se tornan
ácidos y están compuestos por hidrógeno y otro elemento.
Hidróxidos: compuestos por agua y algún óxido básico cuya reacción se caracteriza por
contar con el grupo oxidrilo.
Oxácidos: están compuestos por oxígeno, un no metal e hidrógeno y se obtienen a partir
de la reacción de agua y un óxido ácido
Oxisales: compuestas por la reacción de un hidróxido y un oxácido
Sales binarias: compuestos por un hidróxido y un hidrácido.
REGLAS PARA FORMAR COMPUESTOS
El hidrógeno (H) presenta número de oxidación +1 con los no metales y –1 con los
metales.
El oxígeno (O) presenta el número de oxidación –2, excepto en los peróxidos donde
es –1.
El compuesto se lee de derecha a izquierda
Se intercambian las valencias, pero prescindiendo del signo
Siempre que sea posible se simplifica:
Cu2S2 --> CuS
En cualquier formula química se escribe en primer lugar los elementos situados a la
izquierda de la tabla periódica (menos electronegativos) y en segundo lugar, los situados a
la derecha (mas electronegativos).
SISTEMAS DE NOMENCLATURA.
para nombrar los compuestos químicos inorgánicos se siguen las normas de la IUPAC
(union internacional de química pura y aplicada). se aceptan tres tipos de nomenclaturas
para los compuestos inorgánicos la sistemática y la nomenclatura stock y tradicional.
Hay tres tipos de nomenclatura las cuales son las siguientes:
- Nomenclatura sistemática ( propuesta por la IUPAC)
- Nomenclatura stock
- Nomenclatura tradicional (el sistema mas antiguo)
IUPAC: unión internacional de química pura y aplicada (international union of pure and
applied chemistry IUPAC)
NOMENCLATURA SISTEMATICA:
para nombrar compuetos quimicos segun esta nomenclatura se utilizan los prefijos:
MONO_, DI_, TRI_, TETRA_, PENTA_, HEXA_; HEPTA_.......
ejemplos
Ej. Fe2O3 ----------- Trióxido de dihierro
Ej. PH3 -------------- Trihidruro de fósforo
Ej. Ba(OH)2 -------- Dihidróxido de bario
NOMENCLATURA STOCK:
en este tipo de nomenclatura, cuando el elementos que forma el compuesto tiene
mas de una valencia esta esta indicada al final en numeros romanos y entre
parentesis:
ejemplo:
Ej. Fe2O3 ---------- Óxido de hierro (III)
Ej. PH3 ----------- Hidruro de fósforo (III)
Ej. Ba(OH)2 -------- Hidróxido de bario (II)
NOMENCLATURA TRADICIONAL:
En este tipo de nomenclatura para poder distinguir con que valencia funcionan los
elementos en ese compuestos se utilizan una serie de prefijos y sufijos.
ejemplos:
1 VALENCIA ------------ -ico
2 VALENCIAS ---------- -oso/-ico
3 VALENCIAS ---------- hipo…oso/-oso/-ico
4 VALENCIAS ---------- hipo…oso/-oso/-ico/per…ico
Ej. Fe2O3 ----------- Óxido férrico
Ej. PH3 -------------- Hidruro fosforoso
Ej. Ba(OH)2 -------- Hidróxido bárico
ÓXIDOS
clases de óxidos que son los óxidos básicos y los óxidos ácidos (anhídridos).
OXIDOS BASICOS.
son compuestos formados por la combinacion de un metal y el oxigeno. su formula general
es :
M2 + O
Donde M es el metal y x la valencia del metal ( el 2 corresponde a la valencia del oxigeno)
FeO monoxido de hierro oxido de hierro (II) oxido ferroso
Fe2O3 trioxido de di hierro oxido de hierro (III) oxido ferrico
Li2O oxido de dilitio oxido de litio oxido de litio
OXIDO ACIDOS O ANHIDRIDOS.
Son compuestos binarios formados por un no metal y oxigeno. su formukla general
es:
NM + O
Donde NM, es el no metal y la x la valencia del no metal ( el 2 corresponde a la
valencia del oxigeno) las valencias de los elementos se intercambian entre ellos y se
ponen como subindices.( si la valencia es par se simplifica)
Compuesto Sistemática stock tradicional
SO monoxido de azufre oxido de azufre anhidrido hiposulfuroso
SO2 dióxido de azufre óxido de azufre (IV) Anhídrido sulfuroso
SO3 trióxido de azufre óxido de azufre (VI) Anhídrido sulfúricO
CO2 dióxido de carbono óxido de carbono (IV) Anhídrido carbónico
PERÓXIDOS:
Se caracterizan por llevar el grupo peroxo ( - o - o -) también representado O-1,
los podemos considerar como óxidos con mas oxígenos del que corresponde por
la valencia de este.
En estos compuestos el oxígeno actúa siempre con el número de oxidación -1. Por
tanto, el elemento que se combina con él tiene que utilizar un número de oxidación
positivo.
ejemplo:
H2O2 PERÓXIDO DE HIDRÓGENO
NA2O2 PERÓXIDO DE SODIO
CAO2 PERÓXIDO DE CALCIO
COMPUESTOS BINARIOS: ÓXIDOS SALINOS
Resultan de unir o combinar 2 Óxidos simples de un solo elemento. Son Óxidos
Binarios o también llamados Mixtos
Compuesto Sistemática Stock Tradicional
Co3O4
Tetraóxido de tricobalto
óxido de cobalto (II, III)
oxido Salino de Cobalto.
Óxido doble deCobalto
Óxido mixto de cobalto
COMPUESTOS BINARIOS: HIDRUROS
Son combinaciones del hidrógeno con cualquier elemento químico
Hidruros metálicos: es la combinación del hidrógeno (-1) con un metal
son compuestos binarios formados por u metal e hidrógeno. su formula general es:
M + H
Compuesto Sistemática Stock Tradicional
CaH2 dihidruro de calcio hidruro de calcio hidruro cálcico
LiH hidruro de litio hidruro de litio hidruro lítico
FeH3 trihidruro de hierro hidruro de hierro (III) hidruro férrico
SrH2 dihidruro de estroncio hidruro de estroncio hidruro de estroncio
COMPUESTOS BINARIOS: HIDRUROS NO METÁLICOS (HIDRÁCIDOS)
Hidrácidos: es la combinación del hidrógeno con un no metal (de la primera o
segunda familia). El H tiene valencia +1
COMPUESTOS ESPECIALES
Los hidruros que surgen de combinar el hidrógeno con un no metal (de la tercera o
cuarta familia), se nombran de forma especial
COMPUESTOS TERNARIOS: HIDRÓXIDOS
Los hidróxidos son compuestos constituidos por tres elementos: un metal, oxígeno
e hidrógeno. En los hidróxidos metálicos el oxígeno y el hidrógeno se encuentran
formando uno o más grupos OH (grupos hidroxilo).
Hidróxidos: se pueden formar de dos maneras:
Óxido + H2O
Metal + (OH) (valencia -1).
COMPUESTOS TERNARIOS: OXÁCIDOS
Son compuestos ternarios formados por un no metal, oxígeno e hidrógeno. Se obtienen a partir del óxido ácido o anhídrido correspondiente sumándole una molécula de agua (H2O).
SO3 (s) + H2O(l) = H2SO4 (ac)
N2O5 (g) + H2O(l) = 2HNO3 (ac)
P4O10 (s) + H2O(l) = 4 H3PO4 (ac)
PROYECTO DE AULA
TIPOS DE ENERGIA Y SUS CAMBIOS
ENERGÍAS
TIPOS DE ENERGÍA
La energía es la capacidad que tiene un cuerpo de producir un trabajo o de producir
cambios en las cosas. La energía no es materia, no ocupa espacio ni puede percibirse por
los sentidos. Lo que si podemos percibir son sus manifestaciones o efectos.
Hay distintas formas o manifestaciones de la energía:
Energía luminosa:
Como su nombre lo indica, proviene de la luz solar. El sol emite rayos luminosos y la
actividad de la Tierra se mantiene por la acción de la energía luminosa del Sol. La energía
luminosa está presente en el origen de la mayoría de los fenómenos que observamos. El
día y la noche existen por la proyección de los rayos del Sol sobre la Tierra que está
girando sobre sí misma. También hablamos de energía luminosa aquellas de otras fuentes
como una bombilla.
Energía térmica:
La energía térmica es un tipo de energía liberada en forma de calor como la que se
desprende de objetos calientes como el Sol, una estufa, y cosas que arden en general. La
energía térmica también es conocida por energía calórica o calorífica. La energía térmica
interviene en los procesos caloríficos que consiste en dos cuerpos de diferentes
temperaturas se ponen en contacto, la energía que se transmite de cuerpo a cuerpo
producto de las diferencias de temperaturas es lo que se denomina energía térmica.
Energía mecánica:
La energía mecánica es la energía que presentan los cuerpos en razón de su movimiento
(energía cinética), de su situación respecto de otro cuerpo, generalmente la tierra, o de sus
estado de deformación, en el caso de los cuerpos elásticos. Es decir, la energía mecánica
es la suma de la energía potencial (energía almacenada en un sistema), cinética (energía
que surge en el mismo movimiento) y la elástica de un cuerpo en movimiento.
Energía eléctrica:
La energía eléctrica es la forma de energía que resulta de la existencia de una diferencia
de potencial entre dos puntos, situación que permitirá establecer una corriente eléctrica
entre mambos puntos si se los coloca en contacto por intermedio de un conductor eléctrico
para obtener el trabajo mencionado. Esta energía es capaz de transformarse en
muchísimas otras formas de energía como la luminosa térmica y mecánica. Está presente
en un rayo o en la energía eléctrica de las viviendas.
Energía química:
La energía química es otra de las manifestaciones de la energía y específicamente se trata
de la energía interna que posee un determinado cuerpo y si bien siempre se podrá
encontrar en la materia, solo se nos mostrará cuando se produzca una alteración
importante de ésta. Poniéndolo en términos más sencillos, la energía química es aquella
que está producida por reacciones químicas. Entre los ejemplos más cotidianos que
podemos dar de energía química se cuentan: la energía que emana del carbón cuando
este se quema, las pilas, las baterías, entre otros.
Energía nuclear:
La energía nuclear es aquella que se libera, ya sea de manera espontánea o artificial, en
las reacciones nucleares. A la energía nuclear se la obtiene básicamente a través de dos
maneras, por el proceso de la fisión y fusión nuclear.
Energía hidráulica:
La energía hidráulica es aquella energía que es generada gracias a la utilización de la
fuerza que emana o disponen las corrientes de agua, entre otras, las mareas o los saltos
de agua.
Energía eólica:
La energía eólica es la energía que se obtiene a partir del soplado del viento; las fuertes
corrientes de aire transforman la energía en otras expresiones muy útiles para llevar a
cabo las diferentes actividades humanas.
Energía electromagnética:
La energía electromagnética es la cantidad de energía almacenada en una región del
espacio que podemos atribuir a la presencia de un campo electromagnético, y que se
expresará en función de las intensidades del campo magnético y campo eléctrico.
CAMBIOS DE ENERGÍA
En la naturaleza la energía está sometida a cambios continuos y se transforma de una a
otra forma. Así el calor del sol se transforma en energía mecánica cuando el calentamiento
del aire da lugar a los vientos. También el sol provoca calentamiento del agua, su
evaporación y es el responsable del ciclo del agua.
Gracias a la luz del sol, las plantas realizan la fotosíntesis transformando la energía
luminosa en energía química. Los seres vivos, como nosotros mismos, transformamos la
energía química de los alimentos en energía mecánica cuando nos movemos. El mismo
sol contiene energía nuclear que es continuamente transformada en luz y calor.
Los combustibles son sustancias que almacenan gran cantidad de energía química. Son
combustibles la gasolina, el butano, el gas natural, el carbón, la madera, etc. Cuando estas
sustancias reaccionan con el oxígeno decimos que se produce una combustión o que se
“queman” produciendo luz y calor. En estas combustiones también se producen gases que
al expandirse producen gran cantidad de energía mecánica, es así como funcionan los
motores de explosión de los coches.
Obtención de otras energías a partir de la energía eólica
La energía eólica es una energía abundante y renovable de la naturaleza. Proviene de la
conversión de la energía cinética que traen las masas de aire en movimiento hacia energía
mecánica y luego a energía eléctrica. En esta conversión se utilizan máquinas llamadas
aerogeneradores. Estos dispositivos, a través de una superficie aerodinámica expuesta al
viento, producen trabajo mecánico en un eje. Presentan diseños aerodinámicos para
adaptar distintos tipos de aerogeneradores a las condiciones climáticas de cada zona.
La energía contenida en el viento debe ser transformada, según sea la necesidad, en
energía eléctrica, mecánica o térmica. Las posibilidades de uso de la energía eléctrica son
infinitas. La energía mecánica obtenida del viento puede ser utilizada para el bombeo de
agua o molienda de distintos productos. La energía térmica se consigue a partir de la
energía eólica puede ser usada para generar frío o calor, para procesos industriales.
Obtención de energía eléctrica a partir de la energía química
El fundamento de las pilas y acumuladores, es la transformación de la energía química en
eléctrica, mediante reacciones de oxidación-reducción producidas en los electrodos, que
generan una corriente de electrones. Cuando se unen mediante un hilo metálico dos
cuerpos entre los cuales existe una diferencia de potencial, se produce un paso de
corriente que provoca la disminución gradual de dicha diferencia. Al final, cuando el
potencial se iguala, el paso de corriente eléctrica cesa. Para que la corriente siga
circulando debe mantenerse constante la diferencia de potencial.
En la actualidad, la energía química es la que mueve los automóviles, los buques y los
aviones y, en general, millones de máquinas. Tanto la combustión del carbón, de la leña o
del petróleo en las máquinas de vapor como la de los derivados del petróleo en el estrecho
y reducido espacio de los cilindros de un motor de explosión, constituyen reacciones
químicas.
La energía es una propiedad inherente a la materia. La materia posee energía almacenada
que se debe, por una parte, a la posición o a la altura de un cuerpo (energía cinética) y, por
otra, a la naturaleza o las sustancias de que esté hecho el cuerpo al que se hace
referencia, ya que a cada elemento o compuesto le corresponde cierta cantidad de energía
química almacenada a la que se le denomina contenido energético. Cuando se lleva acabo
un fenómeno químico, éste va acompañado por una manifestación de energía, ya sea que
haya absorción o desprendimiento de ella, debido a la energía química que almacenan las
sustancias
Lo anterior significa que, cuando la energía química almacenada de los reactivos es mayor
que la energía de los productos, hay un excedente de energía que se libera, pues la
energía se mantiene constante, es decir, no se crea ni se destruye.
La base científica de la batería con limones
El fundamento de las pilas y acumuladores es la transformación de la energía química en
eléctrica, mediante reacciones de oxidación-reducción producidas en los electrodos, que
generan una corriente de electrones.
Cuando se unen mediante un hilo metálico dos cuerpos entre los cuales existe una
diferencia de potencial, se produce un paso de corriente que provoca la disminución
gradual de dicha diferencia. Al final, cuando el potencial se iguala, el paso de corriente
eléctrica cesa. Para que la corriente siga circulando debe mantenerse constante la
diferencia de potencial.
Funcionamiento de una pila electroquímica
El funcionamiento de una pila es sencillo, consiste básicamente en introducir electrones en
uno de los extremos de un alambre y extraerlos por el otro. La circulación de los electrones
a lo largo del alambre constituye la corriente eléctrica. Para que se produzca, hay que
conectar cada extremo del alambre a una placa o varilla metálica sumergida en un
electrolito que suele ser una solución química de algún compuesto iónico.
Cuando ese compuesto se disuelve, las moléculas se dividen en iones positivos y
negativos, que se mantienen separados entre sí por efecto de las moléculas del líquido. El
electrolito que utilizó Volta era ácido sulfúrico; cada una de sus moléculas, al disolverse en
agua, se descompone en dos protones H+ (iones positivos) y un ion sulfato SO4- (ion
negativo).
Las varillas metálicas de cobre y cinc constituyen los electrodos, que deben ser
sumergidos en el electrolito sin que lleguen a entrar en contacto. La placa de cobre es el
electrodo positivo o ánodo y la placa de cinc el electrodo negativo o cátodo.
Al reaccionar el electrolito con las varillas se produce una transmisión de electrones, que
han sido extraídos de la placa de cinc, hacia la placa de cobre, con lo que los átomos de
cinc son oxidados e incorporados a la disolución, según la reacción:
Zn?> Zn2++ 2e-
Esto ocurre así y no al revés, del cobre al cinc, porque los átomos de cinc tienen más
tendencia que los de cobre a ceder electrones.
En la varilla de cobre se produce una reducción de los iones hidrógeno H+ de la disolución,
ya que los electrones liberados por los átomos de cinc recorren el hilo conductor hacia la
placa de cobre y son captados por los H+, que se convierten en átomos de hidrógeno y
escapan en forma de gas. Estos electrones en movimiento son los que originan la corriente
eléctrica.
Por su parte, los iones SO4- reaccionan con los cationes Zn2+ y se convierten en
moléculas de sulfato de cinc.
2 H~+2e —> H2
Zn2+ + SO42- —> ZnSO4
Cuando se corta la conexión exterior entre las placas, los electrones no pueden
desplazarse a lo largo del hilo de una placa a otra, con lo que se interrumpe la reacción.
El dispositivo funciona mientras existan átomos de cinc para formar el sulfato
correspondiente. Cuando la placa de cinc se ha desintegrado por completo ya no puede
producirse la reacción, por lo que la pila ya no tiene uso. Por este motivo, las pilas de este
tipo reciben el nombre de pilas primarias.
Obtención de energía eléctrica mecánica.
Vamos a planear el siguiente proyecto de impulsar un vehículo de cuatro ruedas en el que
vamos a utilizar un tipo de energía diferente al que se obtiene directamente de una batería
de 9 Voltios.
Para llevar lo acabo necesitamos aplicar:
Método científico.
Aplicando la obtención de energías existentes en la actualidad antes mencionado
impulsaremos un vehículo de miniatura de cuatro ruedas.
1. Observación del Problema:
La falta de una fuente de energía para mover el vehículo.
2. Hipótesis:
a. El vehículo no se puede moverse por la falta de fuerza que lo impulsará.
b. Con qué tipo de energía el vehículo podrá moverse.
c. El diseño del vehículo será el apropiado por su tamaño y peso.
3. Experimentación:
Primero experimento(literal a), se construye un vehículo con materiales fáciles de adquirir
en casa, una botella de agua, cuatro tapas de Botellones de agua de galón, palillos chinos,
pistola con silicona, tijeras, cinta adhesiva, hoja de sierra, estilete un motor de juguete y
unas hélices elaboradas con plástico de botella.
Una vez ya ensamblado el vehículo se verifica que las hélices estén conectada como
estructura con el motor para que cuando este reciba la energía haga girar las hélices
dándole impulso al vehículo.
Se posiciona los limones en el vehículo conectados en paralelo verificando primero su
voltaje en el que marca 2.35 V., al realizar las pruebas los limones no pueden hacer mover
al motor. Realizando un poco más de investigación los limones no pueden llevar a cabo la
tarea de hacer mover el motor por el amperaje que no es el necesario.
Segundo experimento (literal b), se investiga un poco más en el diseño del vehículo y se
determina que se debe rediseñar el mismo para poder perder peso en su masa y se
determina que hay que generar la energía de otra forma.
Se arma el otro vehículo con los siguientes materiales: Tijeras de Aluminio, estilete, pistola
de silicona, tijeras normales, playo, destornillador fino, palillos de helados, sorbetes,
borrador, pegamento transparente, palillos chinos regla, ligas, plástico de botellas, cartón
de base de vehículo y cartón para carrocería.
Se ensambla el vehículo.

Se construye dos puntos lejanos en el que la liga va instalada de tal manera que el primer
punto la liga queda anclada y el segundo punto la liga va a enrollarse en el eje de las
llantas para que almacene energía dentro de la goma, esta energía contenida tiene que
gastarse de cualquier manera por lo que se procede a eliminarla desenrollándola y a su
vez esto añade revoluciones al eje de las llanta provocando la energía mecánica para
impulsar el vehículo. Luego de esta fuerza ejercida en el vehículo se produce la energía
cinética que es el movimiento del vehículo en desplazamiento por su masa.
El vehículo recorre una distancia de 5.45 m.
4. Conclusión:
El segundo experimento realizado pudo impulsar el vehículo empezando con la energía potencial elástica de la liga que al enrollarse en su parte trasera de las llantas acumuló energía y al desenrollarse produce una energía mecánica que impulsa al vehículo dando paso a la energía cinética que le proporciona al vehículo velocidad y distancia en función a su masa o peso.
video sobvre los tipos de energia, dar clic en el link
SEGUNDO PROYECTO ADICIONAL
Cambio de energía Química a eléctrica
En el presente cambio de energía hemos utilizado como punto referencial a los limones ya que
estos generan energía química gracias a su acidez la cual por medio de 2 metales podremos
hacer que puedan encender una bombilla led.
Materiales a utilizar:
3 limones de preferencia verdes
Alambre de cobre.
Lagartos.
Led (diodo emisor de luz)
Metales (zinc y cobre)
En este experimento consiste en insertar en diversos limones, dos objetos hechos de metales
diferentes, por ejemplo un clavo galvanizado de zinc también denominado zincado (
zincado proceso de deposición electrolítica en baños similar al cromado o cobreado), y
una moneda o lamina de cobre. Estos dos objetos funcionan como electrodos, causando una
reacción electroquímica mediada por el jugo de limón que genera una pequeña cantidad
de energía de corriente eléctrica.
Objetivo del experimento:
Demostrarle a los estudiantes como es el funcionamiento de una pila mediante los limones,
después de que la pila esta ensamblada se puede utilizar un multímetro o voltimetro para
asi poder confirmar si existe voltaje determinado que usualmente no supera 1v y una
corriente aproximada de 0,1 ma como máximo. El voltaje y corriente producido es
insuficiente para lograr encender un led, para lo que se requeriría una batería hecha de
varias pilas de limón.
Se necesitan al menos dos pilas conectadas en serie para duplicar el voltaje y varias conectadas
en paralelo para alcanzar corrientes del orden de 5ma, de esta forma se podrá encender
un diodo led de bajo voltaje.
Reacciones químicas:
Una pila eléctrica es un dispositivo que convierte energía química en energía eléctrica por un
proceso químico transitorio por el cual cesa su actividad y han de renovarse sus
elementos constituyentes puesto que sus características resultan alteradas durante el mismo. Se
trata de un generador primario por el cual esta energía resulta accesible mediante dos
terminales que tiene la pila, llamados polos, electrodos o bornes. Uno de ellos es el polo
negativo (ánodo) y el otro es el polo positivo (cátodo), la estructura fundamental de una
pila consiste en dos electrodos, metálicos en muchos caso introducidos en una disolución
conductora de electricidad.
Técnicamente ocurren la oxidación y la reducción.
En el ánodo el zinc es oxidado
Zn zn2 + 2e
En el cátodo se reducen los iones de hidrogeno presentes en la batería
2h + 2e = h2
Los voltajes y corrientes alcanzados dependen críticamente de los limones ya sea su acidez, el
tamaño y metal de los objetivos usados.
VER VIDEO DE COMO SE FABRICA UNA PILA CON LIMONES DAR CLIC EN EL LINK



































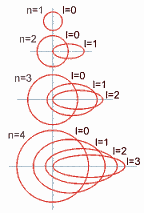














No hay comentarios:
Publicar un comentario